При перепечатке ссылка на источник обязательна.
Протокол опыта №
Дата начала Дата окончания
опыта: 03.02.06 опыта: 04.04.06
Участники эксперимента:
Заведующий отделом биобезопасности ГНЦ ВБ “Вектор” , научный консультант ООО НПФ “Исследовательский Центр”, к.м.н., Е. А. Ставский;
Директор ООО НПФ “Исследовательский Центр” А. И. Леляк;
Заведующая лабораторией отдела биобезопасности ГНЦ ВБ “Вектор”, Ренау И. В.;
Заведующий отделом изучения и мониторинга зоонозных инфекций ГНЦ ВБ “Вектор”, к.б.н., А. М. Шестопалов;
Заведующая лабораторией отдела биобезопасности ГНЦ ВБ “Вектор”, Культенко О. В.;
Главный специалист отдела биобезопасности ГНЦ ВБ “Вектор”, Золин В. В.;
Главный специалист отдела биобезопасности ГНЦ ВБ “Вектор”, Бакшеева Г. П.;
Заведующий лабораторией фило и аренавирусных инфекций, к.б.н., Агафонов А. П.;
Заведующая отделом микроскопических исследований, анализа вирусных маркеров и синтеза биологических реагентов Рябчикова Е.И.;
Ведущий научный сотрудник отдела микроскопических исследований, анализа вирусных маркеров и синтеза биологических реагентов Малкова Е. М.;
Научный сотрудник отдела изучения и мониторинга зоонозных инфекций ГНЦ ВБ “Вектор”, Золотых С. И.;
Заместитель заведующего отделом микроскопических исследований, анализа вирусных маркеров и синтеза биологических реагентов Таранов О. С.;
Младший научный сотрудник отдела изучения и мониторинга зоонозных инфекций ГНЦ ВБ “Вектор, А. В. Зайковская”;
Стажер-исследователь отдела изучения и мониторинга зоонозных инфекций ГНЦ ВБ “Вектор, В. А. Евсеенко.
Цель опыта:
1. Проведение экспериментальной оценки качества ветеринарного пробиотика Ветом 1.1 на экспериментальной модели птичьего гриппа в условиях профилактического скармливания пробиотика цыплятам (5 дней до и 5 дней после заражения).
2. Проведение экспериментальной оценки качества ветеринарного пробиотика Ветом 1.1 на экспериментальной модели птичьего гриппа в условиях начала скармливания пробиотика цыплятам после их заражения (в течение 10 суток после заражения).
3. Проведение экспериментальной оценки качества ветеринарного пробиотика Ветом 1.1 на экспериментальной модели птичьего гриппа в условиях начала скармливания пробиотика цыплятам через 6 после их заражения (длительность 10 суток).
Материалы и методы:
В эксперименте использовали культуру высоко патогенного вируса птичьего гриппа А серотипа Н5N1 штамма A/Turkey/Suzdalka/Nov-1/2005, выделенного из селезенки павшей 20.07.05 г. индюшки из села Суздалка Доволенского района НСО. Штамм депонирован в музейной коллекции культур микроорганизмов ГНЦ ВБ “Вектор”. Для заражения использовали вируссодержащую аллантоисную жидкость (1–й пассаж), полученную после заражения 10% гомогенатом селезенки индюшки 9-ти дневных РКЭ (развивающихся куриных эмбрионов) производства ГППЗ Новосибирский. Аллантоисная жидкость имела титр в реакции гемагглютинации с эритроцитами петуха – 1:256.
Формировали четыре группы кур (по 10 цыплят) согласно задачам 1-3. Группа № 4 – контрольная, без лечения. Цыплят всех групп инфицировали внутривенно по 0,2 мл вирусной суспензии гриппа птиц в дозе 10ЛД50 . Цыплятам групп №№ 1-3 ежедневно автоматичес-кими пипетками вводили per os по 0,5 мл Ветома 1.1 из расчета 108 КОЕ на птицу. Устанавливали ежедневное наблюдение.
Разведения по приготовлению инфицирующей дозы. Брали цельный материал (культура вируса гриппа птиц) и готовили последовательные десятикратные разведения на физиологическом растворе:
ц -10-1 - 10-2 - 10-3 - 10-4 - 10-5 - 10-6 - 10-7 - 10-8. В качестве инфицирующей дозы выбрали
дозу: 10-7.
У цыплят контрольной группы с развитой клинической картиной гриппозной инфекции проводили вирусологический анализ смывов из клоаки и их ПЦР анализ.
Вирусологический анализ проб:
Определение инфекционного титра проводили на перевиваемых культурах клеток MDCK в 24 - луночных культуральных планшетах . Перед посевом клетки подсчитывали в камере Горяева. Готовили клеточную суспензию с посевной концентрацией 1 00 000 клеток / мл . После чего в каждую лунку вносили по 0, 7 мл приготовленной суспензии . Через 2 суток в каждую лунку вносили по 1 мл заранее приготовленных неразведенных сливных проб исследуемого материала . Проводили адсорбцию вируса на клетках в течении 40 мин. После этого вирус-содержащую среду сливали и вносили 0,7 мл питательной среды RPMI, содержащей 10 мкл/мл трипсина. На каждую пробу брали по 4 лунки . Планшеты помещали в эксикатор с горящей парафиновой свечой , после чего эксикатор герметично закрывали крышкой , края которой были предварительно смазаны вакуумной смазкой . После полного затухания свечи эксикатор помещали в термостат при 370 С на 3 суток . Через 3 суток инкубации планшеты , с инфицированными вирусом культурами , просматривали под инвертированным микроскопом для регистрации ЦПД вируса в клетках . Подсчету подвергали лунки , в которых отмечается наличие и отсутствие ЦПД. Дополнительно ставили реакцию гемагглютинации с 1 % раствором эритроцитов петуха [ Вирусология Методы Под ред . Мейхи Б ., М ., Мир – 1998. – 344 с. ].
У погибших цыплят проводили макроскопическое и микроскопическое патологоанатомическое исследование. Гистоморфологическому анализу подвергали образцы тканей легких, печени, селезенки, мышечного желудка, проксимального и дистального отделов тонкого и толстого кишечника.
Полученные данные.
Таблица 1
Динамика гибели инфицированных цыплят
|
Разведение вируса, инфицирующая доза |
№ группы |
Количество цыплят в группе |
Количество погибших цыплят в группе |
Количество больных цыплят в группе |
|
08.02.06 |
1-е сутки после заражения |
|||
|
10-7 |
1 |
8 |
||
|
10-7 |
2 |
8 |
||
|
10-7 |
3 |
8 |
||
|
10-7 КОНТРОЛЬ |
4 |
8 |
||
|
09.02.06 |
2-е сутки после заражения (из групп №№ 1-4 взяты по 2 птицы на гистологию) |
|||
|
10-7 |
1 |
7 (5) |
1 |
2 |
|
10-7 |
2 |
5 (3) |
3 |
3 |
|
10-7 |
3 |
5 (3) |
3 |
2 |
|
10-7 КОНТРОЛЬ |
4 |
5 (3) |
3 |
4 |
|
10.02.06 |
3-е сутки после заражения |
|||
|
10-7 |
1 |
5 |
3 |
1 |
|
10-7 |
2 |
3 |
1 |
1 |
|
10-7 |
3 |
3 |
2 |
1 |
|
10-7 КОНТРОЛЬ |
4 |
3 |
3 |
- |
|
11.02.06 |
4-е сутки после заражения |
|||
|
10-7 |
1 |
- |
1 |
|
|
10-7 |
2 |
2 |
1 |
1 |
|
10-7 |
3 |
- |
1 |
|
|
12.02.06 |
5-е сутки после заражения |
|||
|
10-7 |
2 |
1 |
1 |
|
Таблица 2
Динамика клинических проявлений птичьего гриппа у зараженных цыплят
|
Разведение вируса, Номер группы |
Клинические проявления |
|
08.02.06 |
1-е сутки после заражения |
|
10-7 Группа № 1 |
Все цыплята в группе здоровые на вид, активно двигаются, хорошо едят. |
|
10-7 Группа № 2 |
Все цыплята в группе здоровые на вид, активно двигаются, хорошо едят. |
|
10-7 Группа № 3 |
Все цыплята в группе здоровые на вид, активно двигаются, хорошо едят. |
|
10-7 Группа № 4 |
Все цыплята в группе здоровые на вид, активно двигаются, хорошо едят. |
|
09.02.06 |
2-е сутки после заражения |
|
10-7 Группа № 1 |
1 цыпленок погиб, 2 цыпленка неактивные, нахохленные, малоподвижные, перья тусклые, глаза закрыты, не пьют и не едят. Наблюдается сильный озноб. При визуальном осмотре погибших и заболевших птиц отмечено, что на лапах ткани в области заплюсноплюсневого сустава (цевки) сильно отечные, на кожных покровах ног отчетливые геморрагии. |
|
10-7 Группа № 2 |
3 цыпленка погибли, 3 явно заболевшие, они неактивные, нахохленные, не встают, при попытке поднять принудительно сразу заваливаются на бок, перья тусклые, глаза закрыты, не пьют и не едят. Наблюдается сильный озноб. В конце суток проявились поражения нервной системы в виде судорог. При визуальном осмотре погибших и заболевших птиц отмечено, что цевки сильно отечные, на кожных покровах ног отчетливые геморрагии, в некоторых местах слиты в сплошную гематому. Гребни бледные с одиночными геморрагиями. |
|
10-7 Группа № 3 |
3 цыпленка погибли, 2 явно заболевшие, они неактивные, нахохленные, не встают, при попытке поднять принудительно сразу заваливаются на бок, перья тусклые, глаза закрыты, не пьют и не едят. Наблюдается сильный озноб. В конце суток проявились поражения нервной системы в виде судорог. При визуальном осмотре погибших и заболевших птиц отмечено, что «пятки» сильно отечные, на кожных покровах ног отчетливые геморрагии, в некоторых местах слиты в сплошную гематому. Гребни бледные с одиночными геморрагиями. |
|
10-7 Группа № 4 |
3 цыпленка погибли, 4 явно заболевшие, они неактивные, нахохленные, не встают, при попытке поднять принудительно сразу заваливаются на бок, перья тусклые, глаза закрыты, не пьют и не едят. Наблюдается сильный озноб. В конце суток проявились поражения нервной системы в виде судорог. При визуальном осмотре погибших и заболевших птиц отмечено, что цевки сильноотечные, на кожных покровах ног отчетливые геморрагии, в некоторых местах слиты в сплошную гематому. Гребни бледные с одиночными геморрагиями. |
|
10.02.06 |
3-е сутки после заражения |
|
10-7 Группа № 1 |
3 цыпленка погибли, 1 цыпленок неактивный, нахохленный, малоподвижный, перья тусклые, глаза закрыты, не пьет и не ест. Наблюдается сильный озноб. При визуальном осмотре погибших и заболевших птиц отмечено, что цевки отечные, на кожных покровах ног отчетливые геморрагии. |
|
10-7 Группа № 2 |
1 цыпленок погиб, 1 явно заболевший, он неактивный, нахохленный, не встает, при попытке поднять принудительно сразу заваливаются на бок, перья тусклые, глаза закрыты, не пьет и не ест. Наблюдается сильный озноб. В конце суток проявились поражения нервной системы в виде судорог. При визуальном осмотре погибших и заболевших птиц отмечено, что цевки сильно отечные, на кожных покровах ног отчетливые геморрагии, в некоторых местах слиты в сплошную гематому. Гребни бледные с одиночными геморрагиями. |
|
10-7 Группа № 3 |
2 цыпленка погибли. При визуальном осмотре погибших птиц отмечено, что цевки сильно отечные, на кожных покровах ног отчетливые геморрагии, в некоторых местах слиты в сплошную гематому. Гребни бледные с одиночными геморрагиями. |
|
10-7 Группа № 4 |
3 цыпленка погибли. При визуальном осмотре погибших птиц отмечено, что «пятки» сильно отечные, на кожных покровах ног отчетливые геморрагии, в некоторых местах слиты в сплошную гематому. Гребни бледные с одиночными геморрагиями. |
|
11.02.06 |
4-е сутки после заражения |
|
10-7 Группа № 1 |
2 цыпленка погибли. При визуальном осмотре погибших птиц отмечено, что цевки сильно отечные, на кожных покровах ног отчетливые геморрагии. Гребни бледные с одиночными геморрагиями. |
|
10-7 Группа № 2 |
1 цыпленок погиб, 1 явно заболевший, он неактивный, нахохленный, не встает, при попытке поднять принудительно сразу заваливаются на бок, перья тусклые, глаза закрыты, не пьет и не ест. Наблюдается сильный озноб. В конце суток проявились поражения нервной системы в виде судорог. При визуальном осмотре погибших и заболевших птиц отмечено, что цевки сильно отечные, на кожных покровах ног отчетливые геморрагии, в некоторых местах слиты в сплошную гематому. Гребни бледные с одиночными геморрагиями. |
|
10-7 Группа № 3 |
1 цыпленок погиб. При визуальном осмотре погибшей птицы отмечено, что «пятки» сильно отечные, на кожных покровах ног отчетливые геморрагии, в некоторых местах слиты в сплошную гематому. Гребень бледный с одиночными геморрагиями. |
|
12.02.06 |
5-е сутки после заражения |
|
10-7 Группа № 2 |
1 цыпленок погиб. При визуальном осмотре погибшей птицы отмечено, что «пятки» сильно отечные, на кожных покровах ног отчетливые геморрагии, в некоторых местах слиты в сплошную гематому. Гребень бледный с одиночными геморрагиями. |
Макроскопическая патоморфологическая картина:
группа № 1: геморрагические поражения п/к слоя, единичные геморрагии на печени, отмечается увеличение и вздутие зоба, увеличение сердца и селезенки. Селезенка не дряблая. Легкие нормальные.
группы №№ 2-4: сильно выраженные геморрагические поражения п/к слоя, кровеносные сосуды очень наполнены, «отечные», в легких единичные геморрагии, селезенка увеличена, дряблая, зернистая, зоб увеличен, вздутый, сердце увеличено, печень увеличена, отчетливо видны геморрагические поражения.
Таблица 3
Результаты вирусологического и ПЦР анализов клоакальных смывов
| № пробы | Вирусологический анализ | ПЦР анализ |
| 1 | отр | отр |
| 2 | отр | отр |
| 3 | отр | отр |
| 4 | отр | отр |
Из данных, представленных в табл. 3, следует, что вирус гриппа не был обнаружен в клоакальных смывах птиц (объединенных от двух цыплят из каждой группы, переданных на гистологию). Это может быть объяснено тем, что вирус не успел выделиться и накопиться в клоаке птиц или находился там в очень низких концентрациях.
Патоморфологическое исследование влияния препарата Ветом 1.1 на кур, зараженных вирусом гриппа птиц.
Проведено патоморфологическое исследование для оценки воздействия препарата Ветом на паренхиматозные органы и лимфоидную ткань. Образцы экспериментальных кур фиксировали в 4% параформальдегиде, обезвоживали в спиртах возрастающей концентрации, просветляли ксилолом, заливали в парафин. Для исследования брали легкие, печень, селезенку, мышечный желудок, толстую и тонкую кишку. Срезы толщиной до 5 мкм окрашивали гематоксилином и эозином.
Было исследовано 4 группы животных:
1 - куры, получавшие Ветом за 5 дней до заражения;
2 - куры, получавшие Ветом сразу после заражения;
3 - куры, получавшие Ветом через 6 часов после заражения.
4 - куры, зараженные вирусом гриппа птиц;
Гистопатоморфология легких.
У кур, подвергшихся заражению, но не получавших лечение Ветомом (группа 4), слизистая оболочка мезобронха образует множественные складки, выстлана многорядным цилиндрическим реснитчатым эпителием. На отдельных участках отмечается десквамация поверхностных эпителиоцитов, или же адгезия эритроцитов и единичных гранулоцитов. В просвете мезобронха находится небольшое количество эритроцитов. Бокаловидные клетки диффузно распределяются в эпителиальном слое, их апикальная часть расширена, выглядит оптически прозрачной или содержит светлый эозинофильный секрет. Собственная пластинка слизистой оболочки отечна, полнокровна, интенсивно инфильтрирована мононуклеарами с преобладанием лимфоцитов. Мышечная оболочка выглядит отечной.
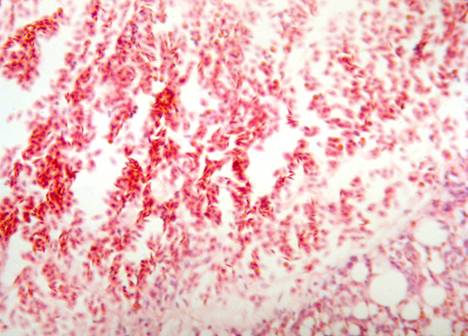
В просветах парабронхов отмечается скопление лимфоцитов, гранулоцитов и эритроцитов. Слизистая оболочка парабронхов выстлана однослойным цилиндрическим и кубическим эпителием, прослеживается десквамация эпителиоцитов. Собственная пластинка слизистой оболочки отечна, полнокровна, инфильтрирована мононуклеарами с большим количеством гранулоцитов. На отдельных участках скопления лимфоидных клеток формируют узелки с расширенными герминативными центрами. Мышечно-эластические элементы отечны. Просветы бронхиол расширены, заполнены клеточными элементами крови. Сосуды мышечного типа полнокровны. Периваскулярные и перибронхиальные пространства расширены, заполнены эритроцитами. Просветы воздушных и кровеносных капилляров полнокровны, содержат большое количество гранулоцитов. На отдельных участках респираторная ткань отсутствует, заменена значительными по протяженности скоплениями эритроцитов. Стенки капилляров при этом не просматриваются, на их месте визуализируются светлые эозинофильные массы (Рис. 1.).
Таким образом, у кур, не получавших лечение, отмечаются проявления отечно-геморрагического синдрома, умеренная воспалительно-клеточная инфильтрация соединительной и респираторной ткани, появление очагов некроза респираторной ткани легких на фоне массивных кровоизлияний.
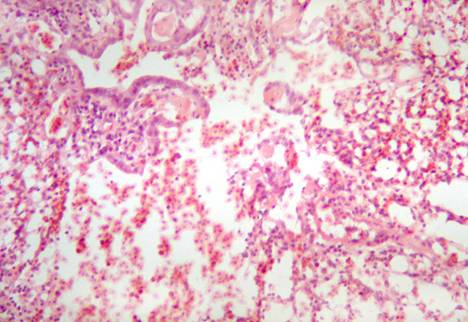
При профилактическом применении препарата за 5 дней до заражения (группа 1) в легких кур отмечен выраженный периваскулярный и перибронхиальный отек. В просветах парабронхов и бронхиол скапливаются форменные элементы крови. В просветах сосудов обращает внимание повышенное количество лимфоцитов (рис. 2). Воспалительно-клеточная
Рис. 1. Легкое курицы, зараженной вирусом гриппа птиц (группа 4). Массивное кровоизлияние в паренхиму легкого. Гематоксилин и эозин. Ув. 200.
инфильтрация респираторной ткани носит очаговый характер. Кровенаполнение капилляров неравномерно, видны небольшие очаги скопления эритроцитов в респираторной ткани.
Рис. 2. Легкое курицы, зараженной вирусом гриппа птиц, после профилактического применения препарата (группа 1). Мелкоочаговая воспалительно-клеточная инфильтрация, полнокровие. Гематоксилин и эозин. Ув. 200.
Таким образом, у кур, профилактически получавших препарат, отмечены умеренно выраженные патологические изменения в виде геморрагических проявлений, а также лимфостаза в сосудах. Степень патологических изменений существенно ниже, чем у кур, не получавших лечение.
Рис. 3. Легкое курицы, зараженной вирусом гриппа птиц, после применения препарата сразу после заражения (Группа 2). Кровоизлияния в паренхиму легких. Гематоксилин и эозин. Ув. 200.
При применении препарата сразу после заражения (группа 2) в легких кур отмечается дистрофия, некроз и десквамация эпителия мезобронха. Форменные элементы крови наполняют просветы бронхов различного уровня, периваскулярные и перибронхиальные пространства. В респираторной ткани легких отмечаются массивные геморрагии, по периферии которых видны некротизированные стенки капилляров. Лимфоциты и гранулоциты образуют небольшие очаговые скопления в паренхиме легких. Прослеживается отек стромы и мышечных элементов (рис. 3).
Таким образом, при применении препарата сразу после заражения патологические изменения бронхов и респираторной части легких кур практически идентичны выявленным в группе птиц, не получавших лечение.
При применении препарата через 6 часов после заражения (группа 3) в легких кур отмечается дистрофия и десквамация эпителия мезобронха. Складывается впечатление о гиперсекреции бокаловидных клеток. Форменные элементы крови наполняют просветы бронхов различного уровня, периваскулярные и перибронхиальные пространства. В респираторной ткани легких отмечаются небольшие кровоизлияния. В паренхиме легких прослеживается диффузная гранулоцитарная инфильтрация. Выражен отек стромы и мышечных элементов.
Таким образом, при применении препарата через 6 часов после заражения патологические изменения бронхов и респираторной части легких кур практически идентичны выявленным в группе птиц, не получавших лечение.
В целом, сравнение состояния ткани легких разных групп птиц показало меньшую выраженность патологических процессов в легких кур, получавших препарат профилактически за 5 дней до заражения (группа 1), по сравнению с курами, не получавшими препарат (группа 4).
Степень выраженности патологических процессов, сопровождающихся нарушением микроциркуляции, развитием геморрагий, дистрофических и некротических изменений эпителиоцитов и эндотелиоцитов, субъективно была несколько ниже в группах 2 и 3, получавших лечение, чем в группе 4. Однако общая тенденция развития патологического процесса свидетельствует об одинаковой направленности развитии заболевания.
Гистопатоморфология печени.
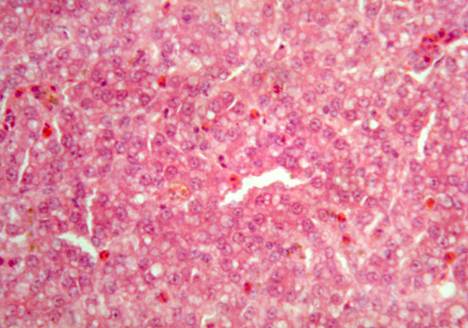
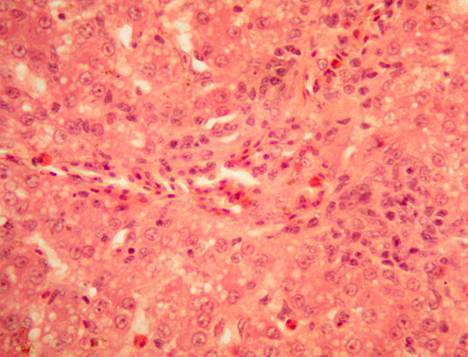
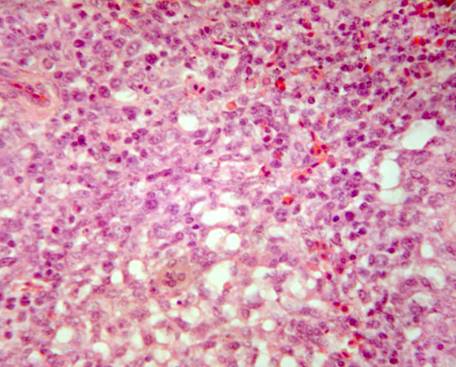
У кур, подвергшихся заражению, но не получавших лечение Ветомом (группа 4), гепатоциты варьируют в размерах. Цитоплазма гепатоцитов эозинофильная со светлыми вакуолями различных размеров. Ядра клеток светлые базофильные с четким ядрышком, в части клеток ядра отсутствуют или имеют пикнотическую деформацию. Отмечается диффузная и мелкоочаговая мононуклеарная гранулоцитарная инфильтрация. Сосуды переполнены мононуклеарами. Перипортальные лимфоидные очаги не выявляются (рис. 4).
Рис. 4. Печень курицы, зараженной вирусом гриппа птиц (группа 4). Дистрофически-некротические изменения гепатоцитов. Редукция перипортальных лимфоидных образований. Гематоксилин и эозин. Ув. 400.
Таким образом, при заражении кур вирусом гриппа отмечается дистрофия и некроз гепатоцитов, исчезновение перипортальных скоплений лимфоцитов.
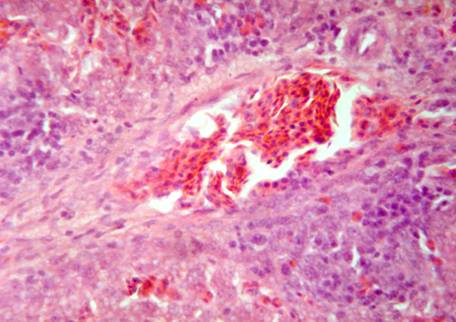
При профилактическом применении препарата за 5 дней до заражения кур (группа 1) в печени отмечаются дистрофические изменения гепатоцитов в виде вакуолизации цитоплазмы. Сосуды и капилляры полнокровны. В перипортальных участках находятся крупные скопления мононуклеаров, включающие лимфоциты, плазматические клетки, гранулоциты (рис. 5). Кроме этого отмечается незначительная диффузная инфильтрация паренхимы гранулоцитами.
Рис. 5. Печень курицы, зараженной вирусом гриппа птиц, после профилактического применения препарата (группа 1). Дистрофические изменения гепатоцитов. Сохранение перипортальных лимфоидных образований. Гематоксилин и эозин. Ув. 400.
Таким образом, у кур, профилактически получавших препарат, отмечены дистрофические изменения гепатоцитов, нарушение микроциркуляции в виде полнокровия, сохранение перипортальных лимфоидных образований.
При применении препарата сразу после заражения кур (группа 2) в цитоплазме гепатоцитов видны множественные крупные вакуоли. Перипортальные лимфоидные образования увеличены в размерах, содержание лейкоцитов в них повышено. Характерна диффузная гранулоцитарная инфильтрация с тенденцией к формированию очаговых скоплений лейкоцитов в паренхиме печени (рис. 6).
Таким образом, при применении препарата сразу после заражения отмечаются дистрофические изменения гепатоцитов, гипертрофия и гиперплазия перипортальных лимфоидных образований, интенсивная воспалительно-клеточная инфильтрация паренхимы.
Рис. 6. Печень курицы, зараженной вирусом гриппа птиц, после применения препарата сразу после заражения (группа 2). Гипертрофия перипортальных лимфоидных образований. Гематоксилин и эозин. Ув. 400.
При применении препарата через 6 часов после заражения кур (группа 3) гепатоциты варьируют в размерах. Цитоплазма гепатоцитов эозинофильная со светлыми вакуолями различных размеров, в части клеток происходит накопление темно-зеленого или желтого пигмента. Ядра клеток светлые базофильные с четким ядрышком, в части клеток ядра отсутствуют или имеют пикнотическую деформацию. Отмечается диффузная и мелкоочаговая мононуклеарная гранулоцитарная инфильтрация. Перипортальные лимфоидные образования варьируют в размерах, однако прослеживается четкая тенденция к их уменьшению.
Таким образом, при применении препарата через 6 часов после заражения отмечены признаки дистрофии и некроза гепатоцитов, холестаза, воспалительно-клеточной инфильтрации паренхимы, прослеживается тенденция к уменьшению лимфоидных образований.
В целом, сравнение состояния ткани печени разных групп птиц показало наиболее выраженные патологические изменения в виде дистрофии и некроза гепатоцитов и истощения лимфоидного ответа при заражении птиц без проведения лечения (группа 4). У кур, получавших лечение через 6 часов от момента заражения, наблюдаются дистрофически-некротические изменения гепатоцитов, признаки нарушения секреции желчи, уменьшается количество и объем лимфоидных образований. При применении препарата сразу после заражения сохраняется активная реакция иммунной системы с признаками ее перенапряжения (гипертрофия и гиперплазия перипортальных лимфоидных образований). При профилактическом применении препарата за 5 дней до заражения признаки развития заболевания наименее выражены по сравнению с другими группами эксперимента.
Гистопатоморфология селезенки.
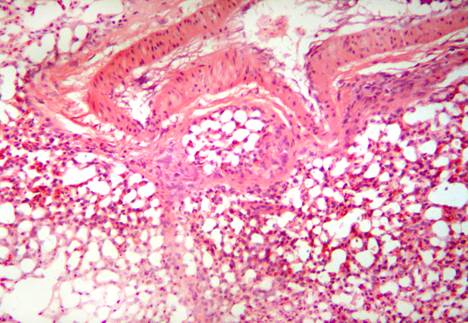
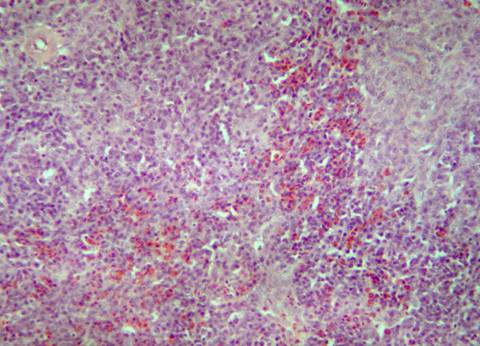
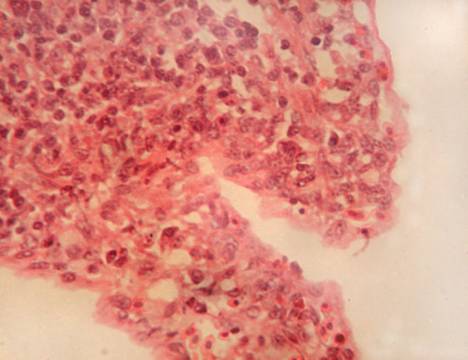
У кур, подвергшихся заражению вирусом гриппа птиц, но не получавших лечение Ветомом (группа 4), красная и белая пульпа дифференцируются с трудом. Видны единичные лимфоидные фолликулы с сохранением лимфоцитов в центре фолликула и опустошением его мантии. Часть фолликулов лимфоидных клеток не содержит. Отмечено появление диффузно распределенных оптически прозрачных вакуолей и очагов аморфного эозинофильного вещества (рис. 7). В красной пульпе количество эритроцитов и гранулоцитов незначительно, их распределение в органе неравномерно.
Таким образом, при заражении кур без проведения лечения отмечается опустошение лимфоидных фолликулов, парез микроциркуляторного русла, некротические изменения.
При профилактическом применении препарата за 5 дней до заражения кур (группа 1) в селезенке дифференцируется красная и белая пульпа. Для белой пульпы характерно значительное уменьшение количества лимфоцитов в фолликулах, расширение и опустошение герминативных центров (рис. 8). В красной пульпе количество лимфоидных элементов и гранулоцитов повышено, количество эритроцитов уменьшено. Часть капилляров расширена, они оптически прозрачны.
Таким образом, у кур, профилактически получавших препарат, отмечается опустошение лимфоидных фолликулов при одновременной лимфатизации красной пульпы.
Рис. 7. Селезенка курицы, зараженной вирусом гриппа птиц (Группа 4). Формирование множественных вакуолей в паренхиме. Гематоксилин и эозин. Ув. 400.
Рис. 8. Селезенка курицы, зараженной вирусом гриппа птиц, после профилактического применения препарата (группа 1). Расширение герминативных центров лимфоидных фолликулов. Полнокровие красной пульпы. Гематоксилин и эозин. Ув. 200.
При применении препарата сразу после заражения кур (группа 2) в селезенке видны крупные лимфоидные фолликулы с расширенными герминативными центрами, часть фолликулов не содержит лимфоцитов. Количество лимфоцитов и эритроцитов в красной пульпе незначительно. Встречаются участки с расширенными оптически прозрачными капиллярами.
Таким образом, при применении препарата сразу после заражения прослеживается опустошение одних лимфоидных фолликулов и гиперплазия других, обеднение красной пульпы, парез капилляров.
При применении препарата через 6 часов после заражения кур (группа 3) встречаются единичные крупные лимфоидные фолликулы с опустошенными герминативными центрами. Видны участки аморфной эозинофильной ткани с включениями пикнотичных ядер. Просветы капилляров расширены, оптически прозрачны. В красной пульпе количество лимфоцитов повышено, прослеживается тенденция к формированию фолликулов. Количество эритроцитов уменьшено.
Таким образом, при применении препарата через 6 часов после заражения отмечена дискоординация лимфоидного ответа, появление очагов некроза и нарушения микроциркуляции.
В целом, сравнение состояния ткани селезенки разных групп птиц выявило реакцию лимфоидной ткани на инфекционный процесс, которая была наиболее выражена в группе животных, получивших лечение через 6 часов после заражения. При профилактическом применении препарата и его применении сразу после заражения также отмечается истощение иммунного ответа, но степень его выражена меньше.
Гистопатоморфология желудка.
У кур, подвергшихся заражению вирусом гриппа птиц, но не получавших лечение (группа 4), слизистая оболочка мышечного желудка не имела непрерывной выстилки затвердевшего секрета желез. В этих участках эпителиоциты имели нарушение целостности апикальной поверхности, изменение тинкториальных свойств цитоплазмы, прослеживалась тенденция к десквамации. Часть клеток, подлежащая базальная мембрана и собственная пластинка слизистой оболочки утрачивали свои структурные признаки. Мышечные слои не имели признаков альтерации. Однако соединительнотканные прослойки были инфильтрированы мононуклеарами, включающими лимфоциты и гранулоциты.
Таким образом, при заражении кур без проведения лечения отмечаются дистрофически-некротические изменения поверхностного эпителия слизистой оболочки желудка, а также воспалительно-клеточная инфильтрация соединительнотканных прослоек.
При профилактическом применении препарата за 5 дней до заражения кур (группа 1) изменений слизистой и мышечной оболочек не выявлено. Соединительнотканные прослойки умеренно инфильтрированы мононуклеарами.
При применении препарата сразу после заражения кур (группа 2) слизистая оболочка желудка сохраняла поверхностный роговой слой. В эпителиоцитах апикальной части желез прослеживались дистрофические изменения. В соединительной ткани – лимфоцитарно-лейкоцитарная инфильтрация.
При применении препарата через 6 часов после заражения (группа 3) слизистая оболочка мышечного желудка кур не имела непрерывной выстилки затвердевшего секрета желез. В этих участках эпителиоциты имели нарушение целостности апикальной поверхности, отмечалась десквамация эпителиоцитов. Часть клеток, подлежащая базальная мембрана и собственная пластинка слизистой оболочки утрачивали свои структурные признаки. Мышечные слои не имели признаков альтерации. Однако соединительнотканные прослойки были инфильтрированы мононуклеарами, включающими лимфоциты и гранулоциты.
В целом, сравнение состояния слизистой оболочки желудка разных групп птиц выявило дистрофически-некротические изменения в группах 4 и 1 (с применением препарата через 6 часов после заражения и не получавших лечение). При применении препарата сразу после заражения (группа 3) отмечены дистрофические изменения эпителиоцитов. В группе 2 не выявлено патологических изменений слизистой и мышечной оболочки. Во всех группах отмечена воспалительно-клеточная инфильтрация соединительной ткани.
Гистопатоморфология тонкой кишки.
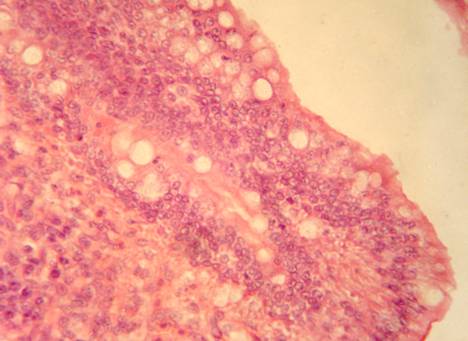
У кур, подвергшихся заражению, но не получавших лечение (группа 4), эпителий слизистой оболочки тонкой кишки десквамирован на значительном протяжении с обнажением базальной мембраны. На сохранившихся участках эпителия (в глубине крипт) выявлены активный трансэпителиальный диапедез, дистрофические изменения эпителиоцитов, лизис апикальной части эпителиоцитов. Собственная пластинка слизистой оболочки отечна, инфильтрирована мононуклеарами (лимфоциты, гранулоциты, макрофаги). Капилляры расширены, их просветы оптически прозрачны.
Таким образом, при заражении кур без проведения лечения отмечаются дистрофически-некротические изменения поверхностного эпителия слизистой оболочки тонкой кишки, нарушения микроциркуляции, признаки воспалительного процесса.
При профилактическом применении препарата за 5 дней до заражения кур (группа 1) отмечена десквамация эпителия, дистрофические изменения эпителиоцитов с изменением тинкториальных свойств цитоплазмы, лизис апикальной части эпителиоцитов (рис. 9). Собственная пластинка слизистой оболочки отечна, инфильтрирована мононуклеарами (лимфоциты, гранулоциты, макрофаги).
Рис. 9. Тонкая кишка курицы, зараженной вирусом гриппа птиц, после профилактического применения препарата (группа 1). Сохранение эпителиального слоя и его функциональной активности. Воспалительно-клеточная инфильтрация собственной пластинки слизистой оболочки. Гематоксилин и эозин. Ув. 400.
При применении препарата сразу после заражения кур (группа 2) слизистая оболочка тонкой кишки имела признаки дистрофии и десквамации эпителия. Формировались участки отслоения эпителия на значительном протяжении (буллы). Выявлялись очаги некроза эпителиоцитов. Собственная пластинка слизистой оболочки отечна, инфильтрирована мононуклеарами (лимфоциты, гранулоциты, макрофаги).
При применении препарата через 6 часов после заражения кур (группа 3) слизистая оболочка тонкой кишки имела признаки дистрофии и десквамации эпителия. Формировались участки отслоения эпителия на значительном протяжении (буллы). Выявлялись очаги некроза эпителиоцитов. Собственная пластинка слизистой оболочки отечна, инфильтрирована мононуклеарами (лимфоциты, гранулоциты, макрофаги).
В целом, сравнение состояния слизистой оболочки тонкой кишки птиц разных групп выявило дистрофически-некротические изменения поверхностного эпителия в группах с применением препарата через 6 часов после заражения и не получавших лечение (группы 3 и 4). В первой группе преобладали дистрофические изменения эпителия. Для 2 и 3 групп характерно появление пузырей при десквамации эпителия. Во всех группах отмечена воспалительно-клеточная инфильтрация соединительной ткани собственной пластинки слизистой и подслизистой оболочки.
Гистопатоморфология толстой кишки.
У кур, подвергшихся заражению, но не получавших лечение (группа 4), эпителий слизистой оболочки толстой кишки десквамирован на значительном протяжении (рис. 10). В сохранившихся участках эпителия прослеживался активный диапедез лимфоцитов и гранулоцитов, дистрофические и некротические изменения клеток. Собственная пластинка слизистой оболочки отечна, инфильтрирована мононуклеарами. Просветы капилляров расширены, оптически прозрачны.
Рис. 10. Толстая кишка курицы, зараженной вирусом гриппа птиц (группа 4). Десквамация поверхностного и бокаловидного эпителия с обнажением базальной мембраны. Интенсивная воспалительно-клеточная инфильтрация собственной пластинки слизистой оболочки. Гематоксилин и эозин. Ув. 400.
При профилактическом применении препарата за 5 дней до заражения кур (группа 1) отмечена очаговая десквамация эпителиоцитов и очаговая гиперплазия эпителия. Формирование небольших субэпителиальных пузырей. Единичные паретические капилляры. Отек и воспалительно-клеточная инфильтрация собственной пластинки слизистой оболочки.
При применении препарата сразу после заражения кур (группа 2) слизистая оболочка толстой кишки имела признаки десквамации и вакуолизации цитоплазмы эпителиоцитов. Формировались участки отслоения эпителия на значительном протяжении (буллы). На фоне отека и воспалительно-клеточной инфильтрации собственной пластинки слизистой оболочки появлялись паретические капилляры.
При применении препарата через 6 часов после заражения кур (группа 3) слизистая оболочка толстой кишки имела признаки десквамации и вакуолизации цитоплазмы эпителиоцитов. Формировались участки отслоения эпителия на значительном протяжении (буллы). На фоне отека и воспалительно-клеточной инфильтрации собственной пластинки слизистой оболочки появлялись паретические капилляры.
В целом, сравнение состояния слизистой оболочки толстой кишки разных групп выявило течение воспалительного процесса во всех группах наблюдения. Степень их выраженности была выше в группе животных не получавших лечение (группа 4).
Заключение
Заражение птиц 8-недельных кур высоко патогенным вирусом птичьего гриппа А серотипа Н5N1 штамма A/Turkey/Suzdalka/Nov-1/2005 приводит к развитию выраженных патологических изменений всех внутренних органов, наиболее глубоко поражаются легкие, пе-чень, селезенка и кишечник. Наблюдаются признаки лимфоидного истощения крайней степени и нарушений в системе кровотока.
Анализ полученных результатов показывает, что препарат Ветом 1.1 оказывает наиболее выражено позитивное действие на гистологическое строение внутренних органов при профилактическом применении в течение 5 дней до заражения (группа 1). В частности, в легких кур этой группы отмечены умеренно выраженные патологические изменения микроциркуляции, в то время как в группах 2 и 3 наблюдались нарушения микроциркуляции с развитием крупных кровоизлияний, дистрофические и некротические изменения эпителиоцитов и эндотелиоцитов.
В печени при профилактическом применении препарата признаки развития заболевания также наименее выражены по сравнению с другими группами эксперимента. У кур группы 2 сохраняется активная реакция иммунной системы с признаками ее перенапряжения (гипертрофия и гиперплазия перипортальных лимфоидных образований). У кур группы 3 наблюдаются признаки дистрофии и некроза гепатоцитов, холестаза, воспалительно-клеточная инфильтрация паренхимы, прослеживается тенденция к уменьшению лимфоидных образований. Наиболее выраженные патологические изменения в виде дистрофии и некроза гепатоцитов и истощения лимфоидного ответа выявлены при заражении птиц без проведения лечения (группа 4).
Характерным для гриппа птиц является резкое уменьшение объема лимфоидной ткани во всех местах ее локализации, наиболее отчетливо проявляющееся в группе 4. В остальных группах эта направленность изменений сохраняется, но имеет меньшую величину. Наименьшие изменения регистрируются у кур группы 1.
Изменения слизистой оболочки желудка не имело специфических признаков и отражало признаки общеинтоксикационного синдрома на фоне воспалительной реакции. Изменения слизистой оболочки кишечника характеризовали течение воспалительного процесса (десквамативно-некротического энтероколита).
Таким образом, применение препарата Ветом не защитило цыплят от развития в их организме экспериментальной смертельной гриппозной инфекции, вызванной внутривенным заражением высоко патогенным вирусом птичьего гриппа. Однако установлено, что применение Ветома 1.1 оказывает положительное действие на гистологическое строение внутренних органов кур, зараженных вирусом гриппа птиц, наиболее выраженное при профилактическом его применении. Возможно, изучение других схем применения препарата позволит подобрать способ его применения, защищающий птиц от гибели.
Заведующий отделом биобезопасности Е. А. Ставский
ГНЦ ВБ “Вектор”, к.м.н.
Директор ООО НПФ А. И. Леляк
“Исследовательский Центр”
Заведующая лабораторией И. В. Ренау
отдела биобезопасности
ГНЦ ВБ “Вектор”
Заведующий отделом изучения и А. М. Шестопалов
мониторинга зоонозных инфекций
ГНЦ ВБ “Вектор”, к.б.н.
Заведующая отделом микроскопических Е. И. Рябчикова
исследований, анализа вирусных маркеров
и синтеза биологических реагентов,
д.б.н., проф.
Заведующая лабораторией О. В. Культенко
отдела биобезопасности
ГНЦ ВБ “Вектор”
Главный специалист отдела В. В. Золин
биобезопасности ГНЦ ВБ “Вектор”
Главный специалист отдела Г. П. Бакшеева
биобезопасности ГНЦ ВБ “Вектор”
Заведующий лабораторией фило и Агафонов А. П.
аренавирусных инфекций, к.б.н.
Ведущий научный сотрудник отдела Е. М. Малкова
микроскопических исследований,
анализа вирусных маркеров и синтеза
биологических реагентов, д.б.н.
Научный сотрудник отдела изучения С. И. Золотых
и мониторинга зоонозных инфекций
ГНЦ ВБ “Вектор”
Заместитель заведующего отделом О. С. Таранов
микроскопических исследований,
анализа вирусных маркеров и синтеза
биологических реагентов
Младший научный сотрудник отдела А. В. Зайковская
изучения и мониторинга зоонозных
инфекций ГНЦ ВБ “Вектор”
Стажер-исследователь отдела изучения В. А. Евсеенко
и мониторинга зоонозных инфекций
ГНЦ ВБ “Вектор”