НОВОСИБИРСКИЙ ГОСУДАРСТВЕННЫЙ
АГРАРНЫЙ УНИВЕРСИТЕТ
ФАРМАКОПРОФИЛАКТИКА И ФАРМАКОТЕРАПИЯ
ПРИ ГИНЕКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЯХ
У КОРОВ С ИСПОЛЬЗОВАНИЕМ ПРОБИОТИКОВ
Министерство сельского хозяйства РФ
Новосибирский государственный аграрный университет
Факультет ветеринарной медицины
ОПТИМИЗАЦИЯ МИКРОБИОЦЕНОЗОВ СРЕДЫ ОБИТАНИЯ
ЖИВОТНЫХ ПУТЕМ НАПРАВЛЕННОГО ИЗМЕНЕНИЯ
МИКРОБНЫХ ЭКОСИСТЕМ С ИСПОЛЬЗОВАНИЕМ ПРОБИОТИКОВ
РЕКОМЕНДАЦИИ
Министерство сельского хозяйства РФ
Новосибирский государственный аграрный университет
Факультет ветеринарной медицины
ОПТИМИЗАЦИЯ МИКРОБИОЦЕНОЗОВ СРЕДЫ ОБИТАНИЯ
ЖИВОТНЫХ ПУТЕМ НАПРАВЛЕННОГО ИЗМЕНЕНИЯ
МИКРОБНЫХ ЭКОСИСТЕМ С ИСПОЛЬЗОВАНИЕМ ПРОБИОТИКОВ
РЕКОМЕНДАЦИИ
Новосибирск 2003
Кафедра фармакологии и общей патологии
Оптимизация микробиоценозов среды обитания животных путем направленного изменения микробных экосистем с использованием пробиотиков: Рекомендации/ Г.А. Ноздрин, А.Б. Иванова, А.Г. Ноздрин. – Новосибирск, 2003. – 52с.
Рецензент профессор В.Н. Грязин
Аннотация: В рекомендациях представлены исследования по изучению влияния пробиотических препаратов на микробиоценозы желудочно-кишечного тракта и репродуктивных органов у сельскохозяйственных животных и среды их обитания. Рекомендации предназначены для ветеринарных врачей, преподавателей и студентов высших учебных заведений ветеринарного профиля.
Рекомендации утверждены и рекомендованы к изданию методической комиссией факультета ветеринарной медицины (протокол № 5 от 1 октября 2003 г.)
© Новосибирский государственный аграрный университет, 2003
ВВЕДЕНИЕ
Болезни сельскохозяйственных животных инфекционной и неинфекционной этиологии наносят животноводству значительный экономический ущерб, который характеризуется большим отходом молодняка, высоким процентом вынужденного убоя, снижением продуктивности и качества продукции.
Многие болезни протекают с развитием иммунодефицитных состояний, сопровождающихся стойким снижением иммунитета и невозможностью адекватной борьбы с проникшим возбудителем болезни. Многие из применяемых для лечения антибиотиков и других антимикробных препаратов являются иммуносупрессорами и могут еще глубже усугубить иммунодефицит и привести не к излечению болезни, а к хронизации ее или прогрессированию. Длительное и не всегда рациональное применение антимикробных препаратов, особенно антибиотиков, способствовало изменению экосистем микроорганизмов, как во внутренней среде организма, так и в среде обитания животных. В связи с широким применением в ветеринарии антибиотики могут проникать в продукты животноводства, не разрушаться даже при термической обработке и оказывать отрицательное влияние на человека. Систематическое поступление антибиотиков в организм может привести к возникновению аллергических заболеваний, образованию устойчивых форм микробов, дисбактериозу, снижению активности защитных функций организма и другим нежелательным явлениям. Поэтому разработка новых средств для профилактики болезней и лечения животных, нормализации микробиоценозов органов пищеварения животных является актуальной задачей ветеринарной медицины.
В последнее десятилетие на основе ряда штаммов Bac. subtilis разработаны, испытаны и утверждены на ветфармсовете ряд оригинальных пробиотических препаратов: ветом 1.1, ветом 3, ветоцил, биосептин и др. Изучение этих препаратов показало, что они обладают выраженным антимикробным действием в отношении условно-патогенной и патогенной микрофлоры. Применение пробиотиков позволит значительно сократить использование антибиотиков, следовательно, значительно уменьшить отрицательное их влияние на экосистемы.
Поэтому изучение влияния новых пробиотических препаратов на микробиоценозы желудочно-кишечного тракта, репродуктивных органов и окружающей среды весьма актуально и имеет большое теоретическое и практическое значение как для повышения эффективности терапии заболеваний органов пищеварения и системы размножения, так и для регуляции экосистем в целом.
ПРОБИОТИКИ КАК ЭКОЛОГИЧЕСКИ БЕЗОПАСНЫЕ СРЕДСТВА ПРОФИЛАКТИКИ И ТЕРАПИИ БОЛЕЗНЕЙ ЖИВОТНЫХ
В настоящее время многие ученые рассматривают совокупность микроорганизмов как микробную экосистему (Нungate R., 1972 и др.). Нормальная микробная экосистема благоприятна для организма животного и человека. Потенциально патогенные микробы могут присутствовать в экосистеме, но экологический баланс такой, что они остаются в количестве, безопасном для организма. В результате действия неблагоприятных факторов происходит нарушение микробной экосистемы, а, следовательно, и изменение экологического баланса, и в экосистеме количество потенциально патогенных микроорганизмов становится преобладающим, что приводит к заболеванию. Одной из уникальных систем, обеспечивающих постоянство внутренней среды макроорганизма, является кишечная микрофлора. Наличие в кишечнике сбалансированного соотношения и оптимального количества аэробных и анаэробных микроорганизмов обеспечивает неспецифическую защиту организма человека от бактерий, вызывающих кишечные инфекции, обеспечивает выработку факторов иммунной защиты. Некоторые виды бактерий участвуют в синтезе витаминов и незаменимых аминокислот. Именно кишечной микрофлоре принадлежит важная роль в нормальной кишечной перистальтике, а также в расщеплении и всасывании продуктов обмена липоидов, белков и углеводов (Шендеров Б.А., 1998).
Состав микробной флоры желудочно-кишечного тракта зависит от набора кормов и условий жизни животных. Достаточно сменить корма, условия содержания, и сразу же меняется состав микроорганизмов.
В рубце жвачных содержится большое количество бактерий, дрожжей и плесеней, расщепляющих кормовые массы и создающих (синтезирующих) многие важные для организма вещества.
Тонкий отдел кишечника относительно менее богат микроорганизмами. Зато в толстом отделе их великое множество, хотя набор видов весьма однообразен. Здесь преобладают разновидности кишечной палочки, некоторые споровые бактерии и энтерококки. Эти микроорганизмы участвуют в сложнейших процессах по расщеплению питательных веществ и особенно клетчатки.
Микроорганизмы, постоянно находящиеся в организме животного, приносят огромную пользу, участвуя в процессах жизнедеятельности. Они же создают в нормальных условиях нетерпимую обстановку для возбудителей заболеваний, которые часто попадают в желудочно-кишечный тракт и другие органы. Однако при снижении уровня неспецифической резистентности организма под влиянием каких-нибудь внешних факторов недавние сожители, а порой и друзья, становятся врагами животного (Аликаев В.А., 1974; Немова М.А., 1968).
Изменение нормального состава микрофлоры желудочно-кишечного тракта животных называется дисбактериозом, который в последние годы имеет широкое распространение. Термином «дисбактериоз» определяют качественное и количественное изменение нормальной микрофлоры в сторону увеличения числа микроорганизмов – симбионтов, которые в норме отсутствуют или встречаются в незначительных количествах. Качественные изменения микрофлоры выражаются как в изменении некоторых свойств кишечной палочки (приобретает гемолизирующие свойства, становится лактозонегативной и др.), так и в изменении удельного веса различных представителей кишечных бактерий.
Нормальная функция кишечника у человека и животных, несмотря на непрерывное поступление в организм патогенных бактерий, может сохраняться лишь при условии равновесия естественного микробиоценоза желудочно-кишечного тракта.
Влияние ряда внешних и внутренних факторов: неправильный или необычный ритм питания, несоблюдение санитарно-гигиенических норм, бессистемное и необоснованное применение антибиотиков и других антибактериальных препаратов, воздействие физических факторов (лучевой энергии, низких температур, атмосферного давления и др.), истощение организма в связи с ростом злокачественных новообразований, аллергическими реакциями, снижением иммунологической реактивности организма - приводит к нарушению динамического равновесия микробных ассоциаций в здоровом организме, то есть к развитию дисбактериоза.
· При дисбактериозе нарушаются не только нормальные соотношения различных физиологических групп микроорганизмов, но и возникают функциональные расстройства. Нарушение нормального состава микрофлоры желудочно-кишечного тракта, обеднение ее полезными бактериями снижает защитные функции, естественную сопротивляемость, приводит к возникновению различных заболеваний и отрицательно сказывается на пищеварении и обмене веществ у животных, следовательно, к снижению продуктивности и качества продукции (Блохина И.М., Дрофейчук В.Г., 1979).
Терапия дисбактериоза кишечника должна проводиться, прежде всего, с учетом степени тяжести процесса, выраженности клинических проявлений, микробного пейзажа кишечника, а также предшествующей терапии, наличия сопутствующих заболеваний (Бондаренко В.М., Боев Б.В., Лыкова Е.А., 1998; Раевский К.К., Добрынин В.М., Кочеровец В.И., 1997).
Современная медикаментозная терапия кишечного дисбиоза предусматривает восстановление эубиоза кишечника, нормализацию процессов пищеварения и всасывания в кишечнике, нарушений его моторно-двигательной функции, коррекцию иммунной реактивности макроорганизма и метаболических нарушений.
Антибиотики и сульфаниламидные препараты сыграли большую роль в борьбе с кишечными инфекциями и другими заболеваниями. Однако длительное и не всегда обоснованное использование этих препаратов приводит к возникновению побочных явлений, в частности дисбактериоза. Под влиянием антибиотиков нарушается состав симбиотической флоры кишечника, полости рта, кожи и других органов макроорганизма. В результате этого происходит интенсивное развитие факультативных представителей бактериальной флоры и условно-патогенных микроорганизмов (стафилококков, протея, гемолитических E. coli, грибов рода Candida и др.). Поэтому необходимо вести поиск средств, обладающих антагонистической активностью в отношении патогенных и условно-патогенных штаммов, противостоящих развитию устойчивости у микроорганизмов и не нарушающих состав полезной микрофлоры. Уже давно внимание ученых стали привлекать препараты бактериального происхождения.
Важнейшая роль в восстановлении нормального микробиоценоза кишечника принадлежит бактерийным препаратам на основе живых микроорганизмов, представителей нормальной микрофлоры, - пробиотикам. В настоящее время появилось новое понятие - биотерапевтические агенты (БТА), представляющие собой препараты микроорганизмов на основе штаммов лактобифидобактерий. Бифидумбактерии, лактобактерин, кисло-молочный бифидумбактерин относятся к категории БТА. Для этих препаратов характерна способность выживать в кислой среде, эффективно прикрепляться к эпителиоцитам, осуществлять колонизацию слизистой, продуцировать антимикробные субстанции, стимулировать иммунную систему, предупреждать избыточный рост и размножение патогенных микроорганизмов, восстанавливать нормальную микрофлору (Запруднов А.М., Мазанкова Л.Н., 1999).
Биологические препараты микробного происхождения, содержащие живые или лиофильно высушенные бактерии различных видов (колибактерин, бификол, лактобактерин, линекс и др.), наряду с положительными эффектами, проявляющимися в благоприятном воздействии на пищеварение, в поддержании и регулировании физиологического равновесия кишечной микрофлоры, обладают рядом существенных недостатков, ограничивающих их эффективность, а именно: ограниченной антагонистической активностью, используемой в производстве штаммов, узким спектром дисбиотической коррекции препаратов, зависимостью эффекта от количества жизнеспособных микробных клеток, содержащихся в препарате, а также от адгезивной способности микроорганизмов, участием микроорганизмов препарата в межмикробных взаимодействиях. Использование препаратов способствовало положительной динамике копрологических показателей: содержание перевариваемой клетчатки, внутриклеточного крахмала и йодофильной микрофлоры.
Очень перспективно применение пробиотиков, изготовленных на основе различных штаммов сенной палочки, содержащих споры этих бактерий — споробактерин, биоспорин, ветом 3, ветоцил, биосептин, ветомгин и их рекомбинантные вариации — ветом 1.1, «Ноздрин» и субалин. Эти препараты подавляют рост и размножение сальмонелл, шигелл, микробов рода протея, стафилококков, грибов рода кандида, кампилобактера и энтеропатогенных кишечных палочек. Сходным действием обладает энтерол (лечебные дрожжи), обладающий антагонистическим действием к клостридиям, некоторым грибам, шигеллам, эшерихиям, псевдомонадам. Параллельно проводятся коррекция моторной функции кишечника, противовоспалительная терапия, стимулирование реактивности организма.
Эффективной мерой (профилактической и лечебной) борьбы с дисбактериозом является применение биологических препаратов, нормализующих микрофлору желудочно-кишечного тракта животных. Особенно эффективны препараты прямого действия, в состав которых входят активные микроорганизмы – представители облигатной микрофлоры пищеварительного тракта. К ним относятся молочно-кислые, целлюлозолитические, лактоферментирующие бактерии, E. coli и др. Что касается препаратов косвенного действия (убитые микробы, продукты микробного синтеза), то они могут активизировать и нежелательную микрофлору (Сизова А.Ф.,1974).
Таким образом, пробиотики являются эффективными лечебно-профилактическими средствами. Их применяют для нормализации экологических систем животных. Эти препараты имеют ряд преимуществ по сравнению с антимикробными средствами других групп. Они физиологичны, имеют выраженную антимикробную активность в отношении патогенных и условно-патогенных бактерий, оказывают иммуностимулирующее и противовоспалительное действие, осуществляют коррекцию моторной функции кишечника. К ним в меньшей степени формируются устойчивые штаммы микроорганизмов. Пробиотические препараты весьма эффективны для обеспечения постоянства микробиологических экосистем.
ВЛИЯНИЕ ВЕТОМА 1.1 И АНТИБИОТИКОВ НА СОСТАВ МИКРОФЛОРЫ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА У ТЕЛЯТ ПРИ ДИСПЕПСИИ И ГАСТРОЭНТЕРИТЕ
· Для изучения влияния ветома 1.1 и антибиотиков на состав микрофлоры при диспепсии и гастроэнтерите проведены научно-производственные опыты в учхозе «Тулинский» НГАУ и ПСЗК «Морские нивы».
В начале болезни у телят всех опытных групп патогенная и условно-патогенная микрофлора была представлена E. coli, Ent. aerogenos и Prot. vulgaris.
В учхозе «Тулинское» при диспепсии у телят обнаруживали в фекалиях E. coli, Ent. aerogenos у 100 %, а Prot. vulgaris – у 12,5 % животных. В ПСЗК «Морские нивы» при гастроэнтерите у телят E. coli была выделена также у 100 %, Ent. aerogenos и Prot. vulgaris – у 50 % (каждый вид). В содержании нормальной микрофлоры (бифидобактерии, лактобактерии и др.) у подопытных телят при диспепсии и гастроэнтерите не было установлено значительных различий.
До лечения в фекалиях животных при диспепсии регистрировали E. coli, Ent. aerogenos по (24±7,4) %, Prot. vulgaris – (4±3,4) %, нормальной микрофлоры – (48±8,7) % от общего количества выделенных штаммов (рис.1). Количество кишечной палочки в опытной и контрольной группах составляло соответственно (341,0±45,2) и (354,0±42,28) млн/г. При этом в опытной группе на долю E. coli со слабыми ферментативными свойствами приходилось (1,5±0,16) %, лактозонегативной – (1,0±0,0) %, гемолитической – (7,5±0,95) %, в контроле - соответственно (2,0±0,82), (1,25±0,25) и (5,0±0,56) %.
В фекалиях животных при гастроэнтерите соотношение штаммов микроорганизмов составляло: E. coli – (25,0±7,6) %, Ent. aerogenos и Prot. vulgaris – по (13,0±5,9) %, нормальной микрофлоры – (49,0±8,8) % от общего количества выделенных штаммов (рис.1). Количество E. coli в опытной группе составило (411,0±4,79) млн/г, а в контроле – (409,±4,11) млн/г. В том числе в опытной группе на долю E. coli со слабыми ферментативными свойствами приходилось (2,75±0,48) %, лактозонегативой – (1,25±0,25) % и гемолитической – (1,0±0,0) %, в контроле – соответственно (1,75±0,75), (1,0±0,0) и (1,0±0,0) %.
Таким образом, из фекалий животных при диспепсии и гастроэнтерите выделяются одни и те же микроорганизмы, но процентное соотношение их несколько различается. При диспепсии в кишечнике телят происходит значительное увеличение E. coli с гемолитическими свойствами по сравнению с ее количеством у телят при гастроэнтерите.
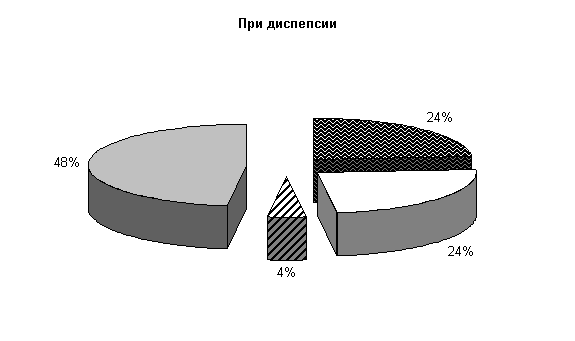
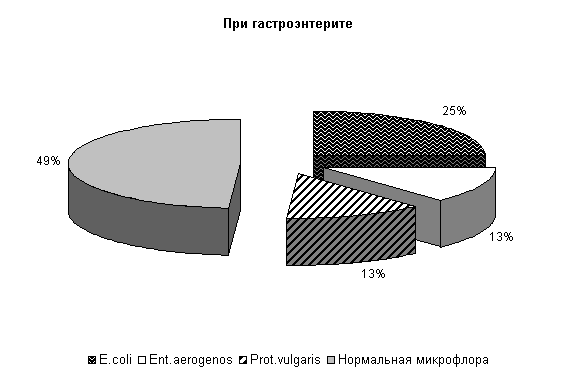
Рис.1. Микробиоценоз кишечника телят в начале эксперимента
У телят опытной группы, получавших при диспепсии ветом 1.1, к 10‑м суткам исследований количество штаммов E. coli составило (26,6±11,4) %, Ent. aerogenos – (6,6±6,4) %, Prot. vulgaris – (13,5±8,8) %, полезной микрофлоры – (53,3±17,4) % от общего числа выделенных микроорганизмов (рис.2).
Количественное содержание E. coli относительно исходных данных изменялось незначительно. Общее количество E. coli в опытных и контрольной группах составляло (365,5±47,4) и (316±41,0) млн/г соответственно. В том числе в опытной группе на долю E. coli со слабыми ферментативными свойствами приходилось (1,75±0,5) %, лактозонегативной – (1,5±0,3) % и гемолитической (1,0±0,0) %, в контроле – соответственно (1,75±0,48), (1,25±0,25), (3,5±2,8) %.
У телят опытной группы, получавших при гастроэнтерите ветом 1.1, к 10-м суткам исследования выделяли E. coli (23±10,2) %, Ent. aerogenos – (12±7,8) %, Prot. vulgaris – (18±9,3) % и нормальной микрофлоры (47±12,1) % (см. рис.2).
Общее количество E. coli в опытной группе при гастроэнтерите было больше на 76,7 % по сравнению с аналогами из контроля (в опытной – (426,0±1,8) млн/г, в контроле – (241,0±26,5) млн/г. В том числе в опытной группе на долю E. coli со слабыми ферментативными свойствами приходилось (2,5±1,5) %, лактозонегативной и гемолитической – по (1,0±0,0) %, в котроле – соответственно (5,5±2,2); (2,5±1,5) и (1,0±0,0) %.
Бактериологический анализ фекалий контрольных животных при диспепсии и гастроэнтерите показал, что на 10-е сутки опыта у них отсутствовала нормальная микрофлора, количество штаммов E. coli составляло (80±17,8) %, Prot. vulgaris – (20±17,8) % (рис.2).
Таким образом, у телят контрольных групп, которым при диспепсии и гастроэнтерите назначали антибиотики, на 10-е сутки опыта полезная микрофлора в фекалиях отсутствовала, и отмечалось резкое увеличение содержания патогенных штаммов E. coli. При этом общее количество E. coli в опытной группе было больше, чем в контроле. У животных опытной группы при диспепсии просматривается тенденция к уменьшению содержания E. coli с гемолитическими свойствами. У телят, получавших ветом 1.1, количество E. coli с гемолитическими свойствами было меньше, чем в контроле, в 3,5 раза. Под влиянием ветома 1.1 на 10-е сутки исследований в фекалиях увеличивалось количество нормальной микрофлоры и значительно уменьшалось содержание патогенных штаммов E. coli.
К 40-м суткам эксперимента у опытных телят при диспепсии из фекалий выделяли нормальную микрофлору – (57,2±13,5) %, E. coli – (28,5±7,1) %, Ent aerogenos – (14,3±5,3) %, в контроле - соответственно (30±9,1), (40±9,3), (20±4,3) % и Prot. vulgaris – (10±3,2) % (рис.3).
Микробиоценоз кишечника телят на 10-е сутки исследования
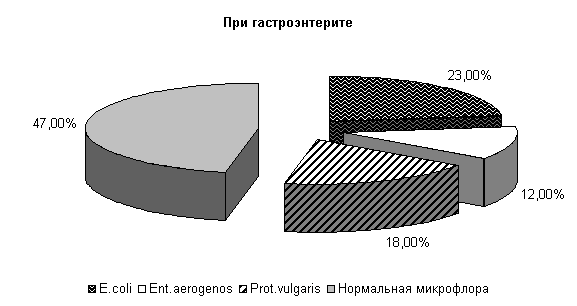
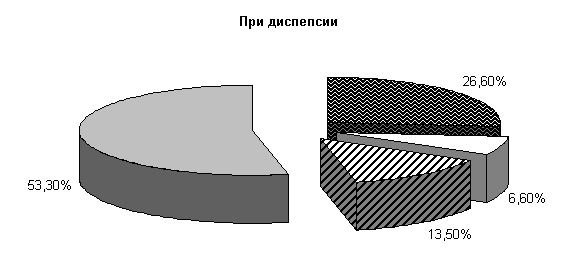

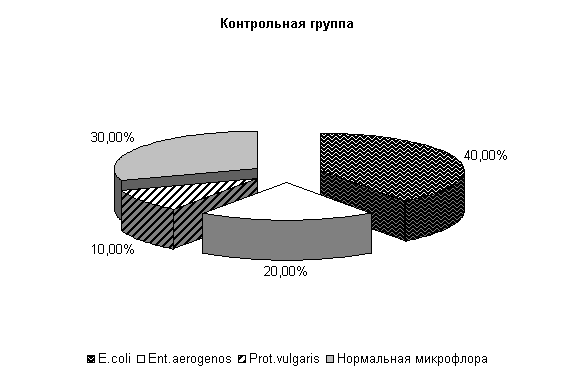
Рис.3. Микробиценоз кишечника телят, больных диспепсией, на 40-е сутки исследования
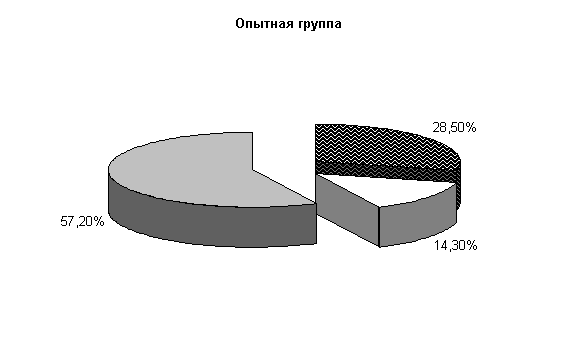
Общее количество кишечной палочки в опытной группе было на 33,9 % больше, чем в контроле. На долю E. coli со слабыми ферментативными свойствами, лактозонегативной и гемолитической приходилось по (1,0±0,0) % в опытной группе и, соответственно, (1,75±0,5), (1,0±0,0), (3,5±2,8) % в контрольной группе.
У опытных животных при гастроэнтерите на 40-е сутки из фекалий выделяли нормальную микрофлору – (67±13,6) % и E. coli – (33±13,6) %, у контрольных – нормальную микрофлолру – (53±12,6) %, E. coli – (31,6±9,5) %, Ent. aerogenos и Prot. vulgaris - по (7,7±10,5) % (рис.4).
Общее количество кишечной палочки в опытной группе на 14,7 % было выше, чем в контроле. В опытной группе на долю E. coli со слабыми ферментативными свойствами приходилось (2,5±0,7) %, латозонегативной и гемолитической по (1,0±0,0) % и, соответственно, (5,0±4,8), (1,5±0,5), (1,0±0,0) % в контроле.
Таким образом, при применении ветома 1.1 и антибиотиков проявляются четко выраженные закономерности по изменению микробной экосистемы в желудочно-кишечном тракте у телят. В начале лечения телят с применением ветома 1.1 повышалось содержание E. coli с нормальными ферментативными свойствами. Происходило угнетение роста гемолитических штаммов E. coli, Pr. vulgaris, St. aureus. Отмечалось увеличение процентного содержания полезной микрофлоры. В процессе лечения продолжалось увеличение содержания E. coli с нормальными ферментативными свойствами и полезной микрофлоры. Изменение микробиологического состава в сторону полезной микрофлоры обеспечивало доброкачественное течение патологического процесса. При применении антибиотиков в начальный период лечения происходит полное подавление нормальной микрофлоры с последующим постепенным восстановлением до исходного уровня и уменьшение общего количества E coli с высоким процентным содержанием ее патогенных штаммов. Содержание Ent. aerogenos и Prot. vulgaris незначительно снижается только в 1-й период терапии с последующим сохранением высокого их уровня. Резкое сокращение полезной микрофлоры приводит к тяжелому течению заболевания и способствует развитию дисбактериозов.
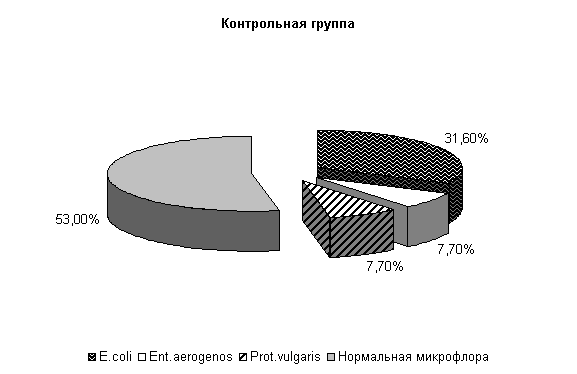

Рис.4. Микробиоценоз кишечника телят, больных гастроэнтеритом, на 40-е сутки исследования
ВЛИЯНИЕ ВЕТОМА 3 И АНТИБИОТИКОВ НА СОСТАВ МИКРОФЛОРЫ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА У ПОРОСЯТ ПРИ ГАСТРОЭНТЕРИТЕ
Для изучения влияния пробиотика ветом 3 на состав микрофлоры желудочно-кишечного тракта при гастроэнтерите у поросят были проведены научно-производственные опыты в учхозе «Тулинское» НГАУ.
Опыты проводили на поросятах 2-месячного возраста с характерными признаками гастроэнтерита. Поросятам опытной группы внутрь назначали ветом 3 в дозе 50 мг/кг 2 раза в сутки до выздоровления. В контрольной группе для лечения применяли традиционные схемы с использованием антибиотиков.
В начале болезни у подопытных поросят нами регистрировалось угнетенное состояние, животные больше находились в лежачем положении, аппетит понижен, фекалии жидкой консистенции со зловонным специфическим запахом. Брюшные стенки напряжены и болезненны при пальпации. У животных из фекалий выделяли патогенные и условно-патогенные штаммы микроорганизмов.
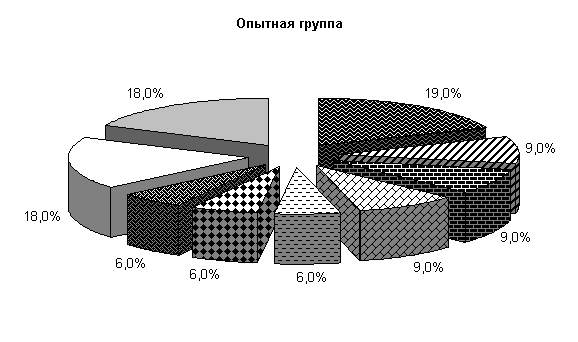
У подопытных животных до лечения из фекалий выделяли патогенную, условно-патогенную и полезную микрофлору Pr. vulgaris, Klebs. oxitoka, Bac. subtilissimus, Bac. megaterium, Bac. polymyxa, E. coli.
У животных опытной группы количество E. coli составляло 19 %, Pr. vulgaris, Klebs. oxitoka и плесневые грибы – по 9 %, Bac. megaterium, Bac. polymyxa, Bac. subtilissimus - по 6 %. В контрольной группе содержание E. coli составляло 17 %, Pr. vulgaris, Bac. megaterium, Bac. polymyxa, Bac. subtilissimus, плесневые грибы - по 9 %, Klebs. oxitoka – 3 %. У животных опытной и контрольной групп содержание молочно-кислых бактерий составляло соответственно 18 и 17 %, бифидумбактерий по 18 % от общего количества выделенных штаммов (рис.5).
Общее количество кишечной палочки в опытной и контрольной группах составляло (185,0±8,8) и (136,8±9,6) млн/г соответственно. В фекалиях поросят опытной группы E. coli с гемолитическими свойствами содержалось 0,009 %, лактозонегативной- 0,72 %, со слабовыраженными ферментативными свойствами – 2,19 %, у аналогов из контроля - соответственно 0,255; 1,09 и 2,86 % от ее общего количества.
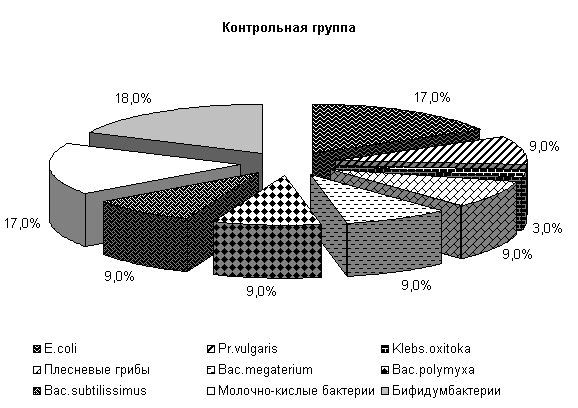
Рис.5. Микробиоценоз кишечника поросят, больных гастроэнтеритом, до лечения
После выздоровления общее количество E. coli в фекалиях животных опытной группы относительно исходных данных увеличилось на 14,75 %. E. coli с гемолитическими свойствами не выделялась, количество лактозонегативных штаммов составляло 0,004 % от общего количества E. coli, что на 99,4 % меньше по сравнению с исходными данными. Содержание штаммов со слабо выраженными ферментативными свойствами понизилось на 81,2 % и составляло 0,41 %.
В фекалиях поросят контрольной группы относительно первоначальных данных общее количество E. coli повысилось на 13,3 %. Уровень лактозонегативных штаммов повысился на 27,5 % и составил 1,39 % от общего количества выделенных штаммов. Количество штаммов со слабовыраженными ферментативными свойствами увеличилось на 63,3 % и составило 7,8 %. Содержание гемолитических штаммов E. соli снизилось на 92,5 % и составило 0,019 % от общего содержания E. сoli.
У опытных поросят после выздоровления изменяется содержание и других видов микроорганизмов. Pr. vulgaris не выделен, содержание Klebs. oxitoka уменьшилось на 1 %, Bac. subtilissimus повысилось на 2 %, Bac. megaterium и Bac. polymyxa снизилось на 2 %. У аналогов из контрольной группы количество Pr. vulgaris повышалось на 2 %, содержание Klebs. oxitoka увеличивалось на 6 %, Bac. subtilissimus и Bac. megaterium уменьшалось соответственно на 3 % и количество Bac. polymyxa не изменилось (рис. 6).
Содержание полезной микрофлоры – молочно-кислых бактерий и бифидумбактерий - у поросят опытной группы увеличилось на 5 %, в контрольной группе содержание молочно-кислых бактерий не изменилось, а бифидобактерий уменьшилось на 1 % (рис.6).
Таким образом, под влиянием ветома 3 и окситетрациклина гидрохлорида изменяется микробиоценоз кишечника.
При назначении ветома 3 происходит увеличение общего количества E. coli при уменьшении содержания ее патогенных штаммов. Также увеличивается рост полезной микрофлоры, что не только обеспечивает доброкачественное течение патологического процесса и более высокий терапевтический эффект, но и снижает бактериальную обсемененность окружающей среды этими штаммами. Следовательно, ветом 3, уменьшая количество патогенных штаммов E. сoli, может способствовать снижению заболеваемости у поросят в ранний постнатальный период жизни. У поросят контрольной группы при применении антибиотика происходит также увеличение общего количества E. coli, но за счет повышения титра патогенных штаммов. Количество полезной микрофлоры понижается.
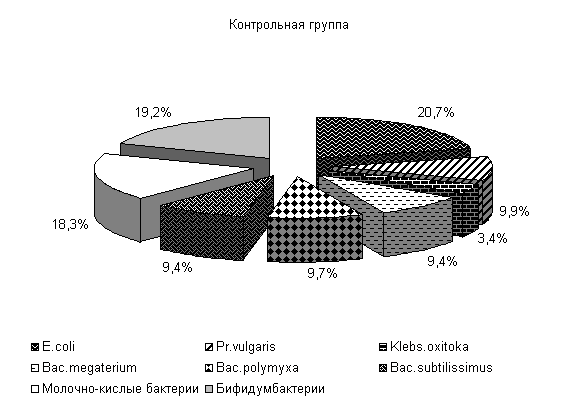
Рис.6. Микробиоценоз кишечника поросят после выздоровления

ВЛИЯНИЕ ВЕТОМГИНА НА СОСТАВ МИКРОФЛОРЫ МАТКИ У КОРОВ ПРИ ОСТРОМ ГНОЙНО-КАТАРАЛЬНОМ ЭНДОМЕТРИТЕ
Для изучения влияния пробиотика ветомгин на микробиоценоз матки коровам вводили внутриматочно ветомгин по 1, 2 и 3 суппозитория.
Коров опытной группы лечили препаратами ветомгин и «Ноздрин» по разработанной нами схеме. Животных контрольной группы лечили по традиционной для каждого хозяйства схеме с использованием антибиотиков. В совхозе-колледже «Новосибирский» для лечения коров применяют левотетрасульфин в дозе 60 мл 1 раз в сутки до выздоровления.
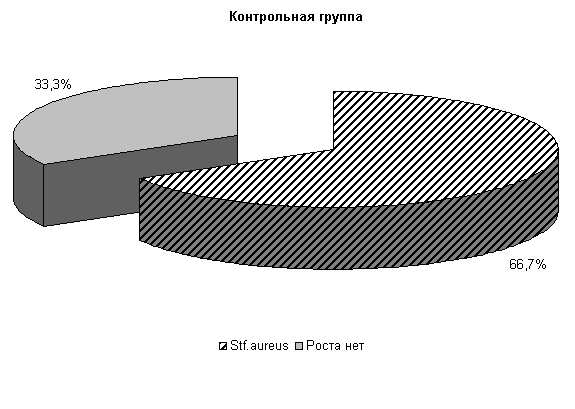
В СК «Новосибирский» при бактериологическом исследовании цервикальной слизи нами установлено, что течение острых гнойно-катаральных эндометритов у коров в летний период в 75 % случаев осложняется обсеменением матки патогенной и условно-патогенной микрофлорой, которая представлена Ps. aeruginosa - 58.4 %, E. coli и споровыми палочками - по 8,3 % (рис.7). Интенсивность роста колоний была высокой (2,9±0,11 балла).
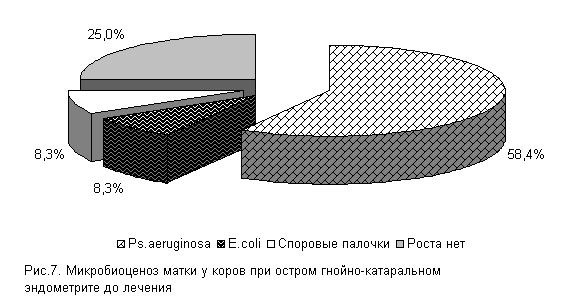
У подопытных коров в первый период заболевания шло интенсивное проникновение в родовые пути условно-патогенной микрофлоры. И к 5-му дню эксперимента у 100 % подопытных животных в пробах цервикальной слизи выделяли различные штаммы микроорганизмов. Однако введение испытуемых средств уже в этот период способствовало позитивным изменениям микробной экосистемы репродуктивных органов.
В цервикальной слизи коров, получавших ветомгин и «Ноздрин», микрофлора была представлена Ps. aerugunalis и E. coli, а в контроле выделяли 3 вида бактерий, причем значительную часть составляли энтерококки.
У коров 1-й, 2-й и 3-й опытных групп Ps. aeruginosa и E.coli выделяли у 66,6 % коров. У них обнаружены монокультуры по 33 % Ps. aeruginosa и E. coli. Проведение традиционной терапии не оказывало выраженного влияния на патогенные и условно-патогенные штаммы микроорганизмов. В пробах цервикальной слизи контрольных животных обнаруживали 50 % Ps. aeruginosa, 17 % - E. coli и 33 % - Proteus vulgaris. Нами выявлена тенденция к снижению интенсивности роста колоний бактерий, выделяемых из цервикальной слизи коров опытных групп по сравнению с аналогами из контроля соответственно на (20–28) % (рис.8).
К 10-му дню эксперимента в опытных группах наблюдалась явная тенденция к подавлению роста патогенных и условно-патогенных штаммов микроорганизмов.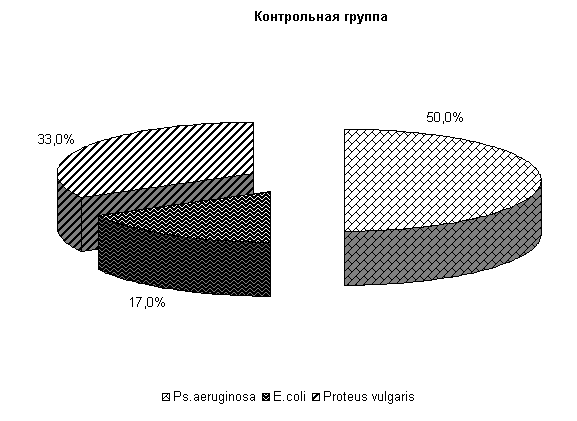
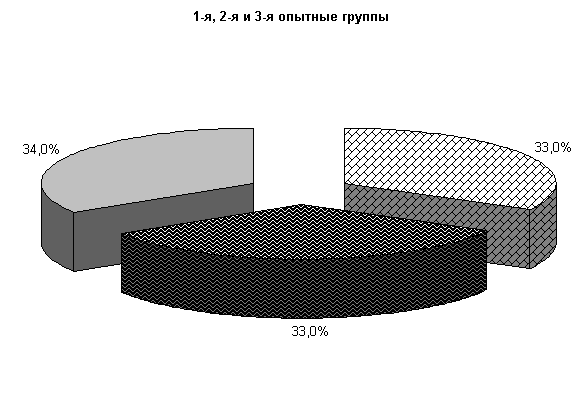
Рис.8. Микробиоценоз матки у коров на 5-е сутки исследования
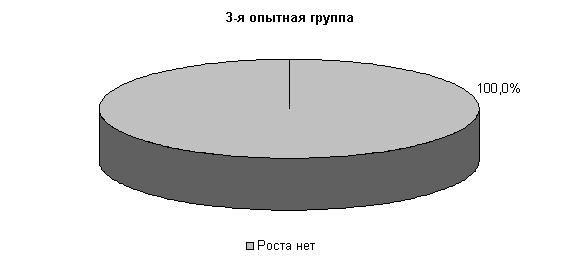
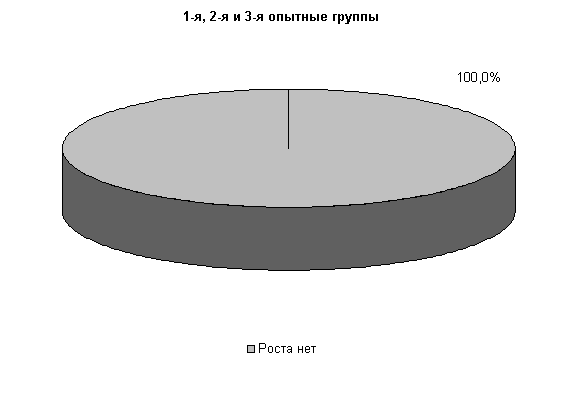
У коров 1-й и 2-й опытных групп E. coli выявлялась у 33,3 % животных, в то время как в 3-й опытной группе патогенные и условно-патогенные бактерии не выделялись. В пробах цервикальной слизи контрольных животных обнаруживали 30,3% Pr. vulgaris. Интенсивность роста колоний в этот период снижалась в 1-й и 2-й опытных группах, по сравнению с контролем, на 50%, а в 3-й опытной группе рост колоний не регистрировали (рис.9).
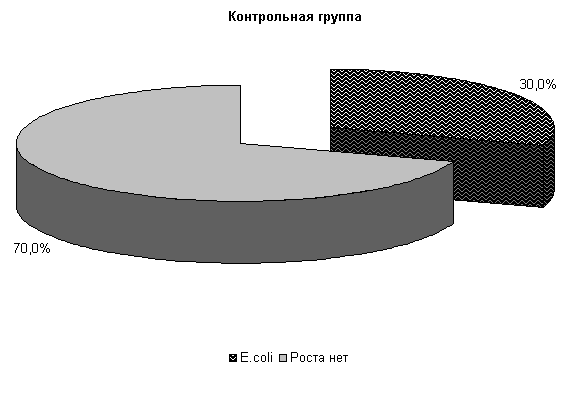
На 20-е сутки исследований в пробах цервикальной слизи коров 1-й, 2-й и 3-й опытных групп патогенная и условно-патогенная микрофлора не обнаружена. Проведение терапии по традиционной схеме не оказывало выраженного влияния на условно-патогенную флору и не предохраняло родовые пути от повторного обсеменения. В пробах слизи у коров контрольной группы наблюдался рост E. coli в 30% случаев (рис.10).
Присутствие в цервикальной слизи условно-патогенной микрофлоры после проведения традиционного лечения свидетельствует о незавершенности воспалительного процесса и возможности перехода заболевания в хроническую форму.
Из результатов опыта видно, что испытуемый препарат ветомгин оказывает выраженное антагонистическое действие на Ps.aeruginosa, E. coli и споровые палочки.
· В ГПС «Пашинском» эксперимент проводился в зимний стойловый период. Изменение условий содержания и кормления животных отрицательно сказалось на неспецифической резистентности их организма и устойчивости к неблагоприятных факторам внешней среды. При этом у 100±0% коров с диагнозом послеродовой острый гнойно-катаральный эндометрит в цервикальной слизи обнаруживали патогенные и условно-патогенные штаммы микроорганизмов. Причем микрофлора была полимикробна. Во всех подопытных группах обнаружена ассоциация синегнойной палочки с протеем, свидетельствующая о злокачественном течении заболевания у коров в данном хозяйстве. Интенсивность роста колоний микроорганизмов из цервикальной слизи в этот период соответствовала 2,9±0,11 балла.
· У коров опытных групп в зимний стойловый период при бактериологическом исследовании цервикальной слизи до применения препарата ассоциации из 3 видов бактерий обнаружены у 60%, ассоциации микроорганизмов из 2 культур - у 40 % животных. Состав микрофлоры влагалищной слизи представлен: E. coli и St. aureus по 29 %, Str. pneumoniae – 19 %, Pr. vulgaris – 14 %, Mic. pyogenus – 7 % и Bac. pyocyneum – 2 %. У 6 % подопытных животных выделяли ассоциацию из 2 культур микроорганизмов: Bac. pyocyneum и Pr. vulgaris (рис. 11).
Рис.9. Микробиоценоз матки у коров на 10-е сутки исследования


·
· Рис.10. Микробиоценоз матки у коров на 20-е сутки лечения
· На 10-е сутки эксперимента у животных 1-й опытной группы во влагалищной слизи выделяли E. coli и St. aureus по 50 %, 2-й опытной группы - E. coli и Pr. vulgaris по 25 % и St. aureus 50 % (рис. 12) .

У животных контрольной группы бактериальная обсемененность матки и влагалища продолжала оставаться очень высокой (E. coli – 14 %, St. aureus –43 %, Bac. pyocyneum –14 % и Pr. vulgaris – 29 %). В этот период в пробах слизи у 6 % коров выделена ассоциация Bac. pyocyneum и Pr. vulgaris, что свидетельствует о переходе заболевания в злокачественную, затяжную форму.
К 20-му дню эксперимента испытуемые средства оказали выраженное влияние на состав патогенной и условно-патогенной микрофлоры.
У животных 1-й опытной группы во влагалищной слизи выделяли E. coli – 100 %, во 2-й опытной - E. coli и Pr. vulgaris по 50 %, в контрольной - E. coli и Pr. vulgaris по 50 % (рис.13).
Высокой антимикробной активностью ветомгин обладал при применении по 2 суппозитория 2 раза в сутки. При этом у коров, которых лечили по традиционной схеме, патогенные и условно-патогенные штаммы обнаруживались в 75 % случаев, что в 2-3 раза больше, чем при применении испытуемых средств. Следовательно, в зимне-стойловый период в матке преимущественно обнаруживаются ассоциации из 2 и 3 микроорганизмов и этим объясняется более тяжелое течение заболевания.
Побочные явления при применении препарата не отмечали.
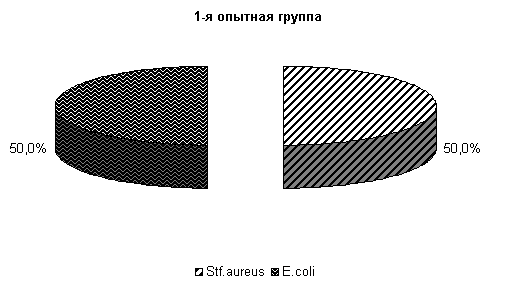
Рис.12. Микробиоценоз матки коров на 10-е сутки лечения
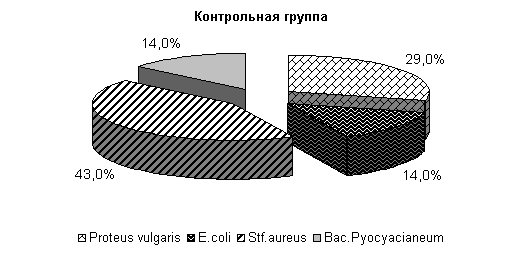

Рис.13. Микробиоценоз матки коров на 20-е сутки исследования


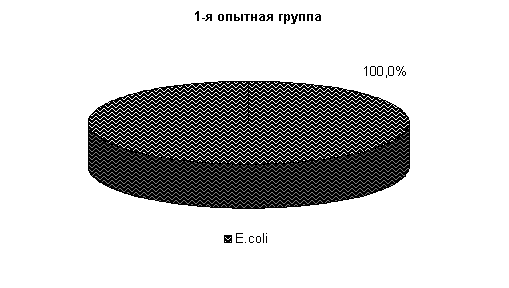
ВЛИЯНИЕ ВЕТОМГИНА НА БАКТЕРИАЛЬНУЮ ОБСЕМЕНЕННОСТЬ И КАЧЕСТВО МОЛОКА
Установлено, что у коров при остром гнойно-катаральном эндометрите при отсутствии воспаления молочной железы регистрируются незначительные изменения физических свойств молока. У всех подопытных животных до применения ветомгина незначительно снижается плотность [(1,0217–1,0253) г/см?], а кислотность [(9,80–16,57) ?Т] и уровень рН молока увеличиваются (6,9–7,4) при стабильности показателя жирности (3,3–3,4).
У коров, больных острым гнойно-катаральным эндометритом, отмечалось снижение молочной продуктивности на 1,3 л по сравнению со средним удоем по стаду.
Ветомгин не оказывал влияния на физические свойства молока. В процессе выздоровления животных плотность и кислотность молока приходят в норму. При гнойно-катаральном эндометрите у 68,9 % коров повышалась бактериальная обсемененность молока.
До применения препарата из молока выделяли: Stf. aureus – 13,3 %, St. epidermidis – 18,3 %, Enterococcus fecalis – 21,1 % и споровой палочки 16,6 % (рис.14).
Интенсивность роста колоний микроорганизмов в этот период соответствовала (2,5±0,17) балла.
На 5-е сутки исследования у животных 1-й, 2-й и 3-й опытных групп в молоке отсутствовали споровые бактерии, а в отношении другой микрофлоры не установлено достоверных различий относительно исходных данных. У животных контрольной группы из молока выделялись Stf. aureus – 47 %, St. epidermidis – 10 %, Enterococcus fecalis – 38 % и споровые палочки 5 %. Интенсивность роста колоний была высокой и составляла (2,0±0,01) балла (рис.15).
К 10-му дню эксперимента у коров 1-й, 2-й и 3-й опытных групп микрофлора была представлена только Stf. aureus – 23; 31 и 27 % соответственно. У животных контрольной группы микрофлора молока была представлена Stf. aureus – 67 %, Enterococcus fecalis – 33 %. Интенсивность роста колоний бактерий снижалась и находилась в пределах 1,0±0,001 (рис. 16).
В последующий период влияние ветомгина на патогенные и условно-патогенные штаммы микроорганизмов в молоке выражалось более ярко. На 20-е сутки исследования в пробах молока коров 1-й, 2-й и 3-й опытных групп патогенная и условно-патогенная микрофлора не обнаружена. Проведение терапии по традиционной схеме не оказывало выраженного влияния на бактериальную обсеменённость молока. В пробах молока у коров контрольной группы наблюдался рост Stf. aureus в 66,7 % случаев (рис.17).
Таким образом, при остром гнойно-катаральном эндометрите бактериальная обсемененность молока повышается, но это явление не всегда сопровождается воспалением молочной железы.
У коров при остром гнойно-катаральном эндометрите при отсутствии воспаления молочной железы происходят незначительные изменения физических свойств молока. Плотность молока незначительно снижается, а кислотность повышается. Следовательно, качество молочной продукции несколько ухудшается. Под влиянием ветомгина качество молока не изменялось.

Ветомгин при внутриматочном применении оказывает антимикробное действие в отношении микрофлоры молока, проявляя антагонистическое действие на St. epidermidis, Enterococcus fecalis и споровую палочку и в меньшей степени на Stf. aureus.
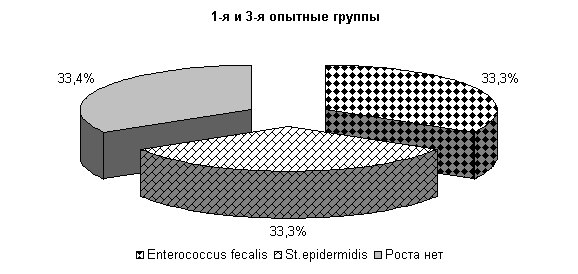
Рис.15. Микробиоценоз молока у коров при остром гнойно-катаральном эндометрите на 5-е сутки исследования
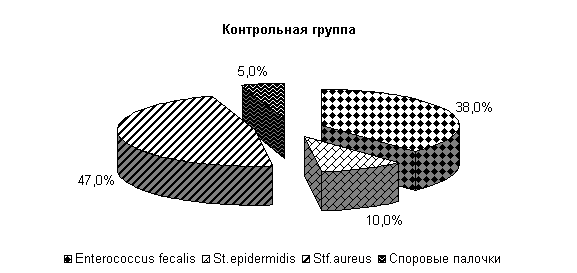
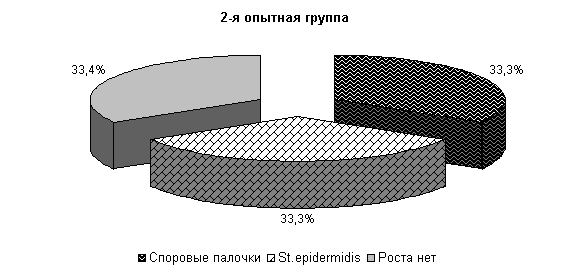
Рис.16. Микробиоценоз молока у коров при остром гнойно-катаральном эндометрите на 10-е сутки исследования
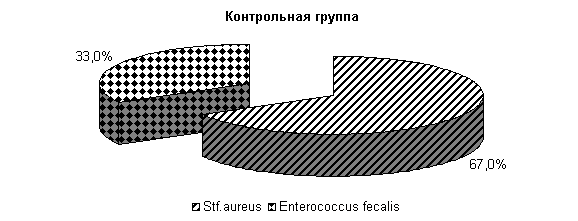


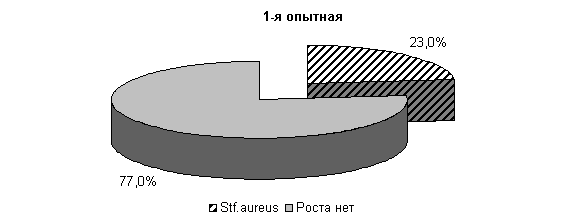
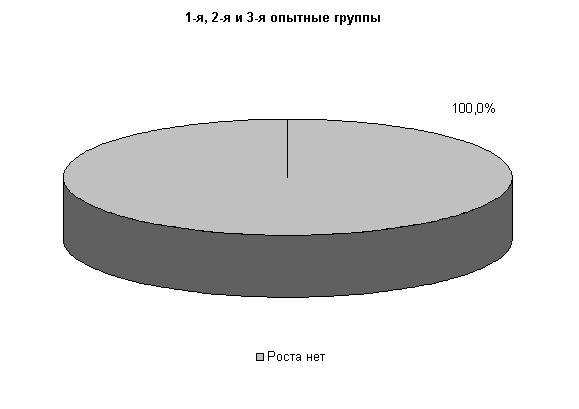
Рис.17. Микробиоценоз молока у коров при остром гнойно-катаральном эндометрите на 20-е сутки исследования
ВЛИЯНИЕ ВЕТОМА 3 НА СОСТАВ МИКРОФЛОРЫ ОРГАНОВ ПИЩЕВАРЕНИЯ У ЦЫПЛЯТ
Для изучения действия пробиотиков на микрофлору желудочно-кишечного тракта цыплят проведены опыты на ЗАО Птицефабрика «Октябрьская» Новосибирской области. Цыплятам 1-й и 2-й опытных групп кросса ISA применяли пробиотик ветом 3 внутрь по 75 мг/кг массы 2 и 1 раз в сутки через 24 часа в течение месяца.
При исследовании фекалий у цыплят суточного возраста до применения препарата в содержимом кишечника выделены бифидобактерии, молочно-кислые бактерии и E. coli (рис.18). По видам бактерий в содержимом кишечника отмечали наибольшее количество E. coli [(5,16±0,12) lg КОЕ/г], численность бифидобактерий [(4,3±0,34) lg КОЕ/г] и молочно-кислых бактерий [(2,3±0,34) lg КОЕ/г] была немного ниже (табл.1).
Таблица 1. Количество микроорганизмов в содержимом кишечника цыплят в начале опыта, lg КОЕ/г
|
Показатели |
Группа |
|||||
|
1-я опытная |
2-я опытная |
Контрольная |
||||
|
М±m |
Cv |
М±m |
Cv |
М±m |
Cv |
|
|
Бифидобактерии |
4,3±0,34 |
13,7 |
4,3±0,34 |
13,7 |
4,3±0,34 |
13,6 |
|
Молочно-кислые бактерии |
2,3±0,34 |
25,6 |
2,3±0,34 |
25,6 |
2,3±0,34 |
25,6 |
|
E.coli норм. фермент. актив. |
5,16±0,12 |
4,3 |
5,16±0,12 |
4,3 |
5,16±0,12 |
4,3 |
·
· Под влиянием ветома 3 происходило изменение микробного пейзажа кишечника цыплят-бройлеров (табл.2).
Таблица 2. Количество микроорганизмов в содержимом кишечника цыплят
в 20-суточном возрасте, lg КОЕ/г
|
Показатели |
Группа |
|||||||||||||
|
1-я опытная |
2-я опытная |
Контрольная |
||||||||||||
|
М±m |
Cv |
М±m |
Cv |
М±m |
Cv |
|||||||||
|
Бифидобактерии |
8,66±0,25* |
2,26 |
8,43±0,22# |
2,36 |
8,0±0 |
- |
||||||||
|
Молочно-кислые бактерии |
5,66±0,34 |
3,4 |
5,33±0,67 |
7,25 |
5,0±0,57 |
16,6 |
||||||||
|
E.coli норм. фермент. актив. |
7,58±0,38 |
8,8 |
7,64±0,24 |
5,3 |
7,7±0,35 |
7,9 |
||||||||
У цыплят 1-й и 2-й опытных групп в возрасте 20 суток количество бифидобактерий составило 39,5 и 39,4 %, молочно-кислых бактерий – 25,8 и 24,9 %, E. coli - 34,6 и 35,7 %. У птицы контрольной группы выделяли 37,2 % E. coli, 38,6 % бифидобактерий, молочно-кислых бактерий 24,2 % (рис. 19).
Относительно исходных данных у цыплят 1-й и 2-й опытных группколичество бифидобактерий увеличивалось соответственно в 23 и 13,5 тыс. раз. По сравнению с аналогами в контроле количество бифидобактерий в этих опытных группа было выше на 8,2 и 4,1 %.
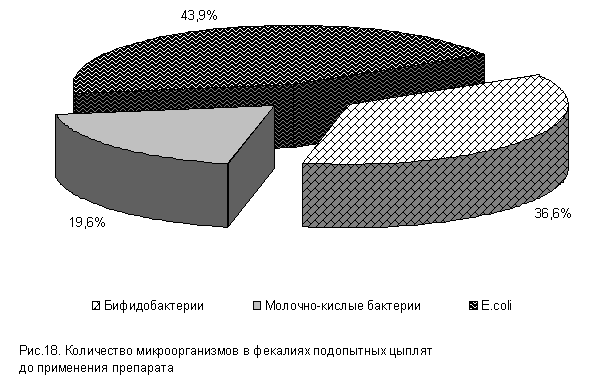
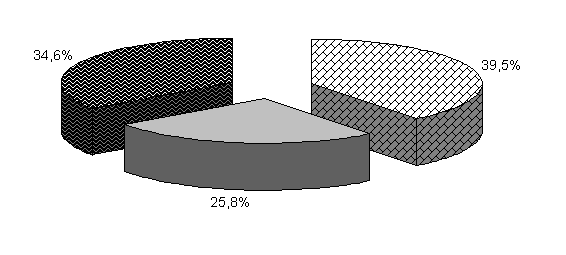

Рис.19. Количество микроорганизмов в фекалиях подопытных цыплят в 20-суточном возрасте
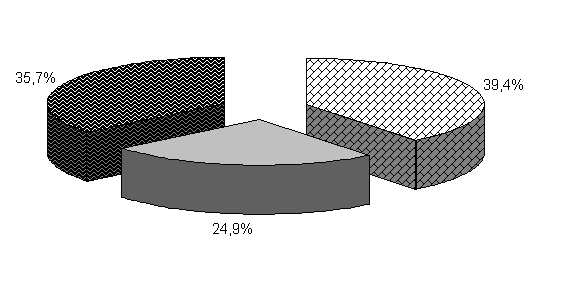
Количество молочно-кислых бактерий в фекалиях цыплят 1-й и 2-й опытных групп относительно исходных данных увеличивалось в 2,3 и 1,07 тыс. раз соответственно и превышало показатели цыплят из контроля на 13,2 и 6,6 %. Количество E. coli у цыплят 1-й и 2-й опытных групп относительно исходных данных увеличивалось в 262 и 303,4 раза соответственно. Содержание E. coli в фекалиях цыплят 1-й и 2-й опытных групп было ниже относительно цыплят из контроля на 1,4 и 0,8 % (табл.2).
У цыплят контрольной группы также происходило увеличение изучаемых микроорганизмов, но в меньших количествах (за исключением E. coli): бифидобактерий – в 5 тыс. раз, молочно-кислых бактерий – в 500 раз, E. coli в – 344,8 раза.
Таблица 3. Количество микроорганизмов в содержимом кишечника цыплят
в 40-суточном возрасте, lg КОЕ/г
|
Показатели |
Группа |
|||||
|
1-я опытная |
2-я опытная |
Контрольная |
||||
|
М±m |
Cv |
М±m |
Cv |
М±m |
Cv |
|
|
Бифидобактерии |
8,66±0,34 |
2,26 |
8,33±0,34 |
2,36 |
8,33±0,2 |
6,2 |
|
Молочно-кислые бактерии |
5,97±0,34 |
3,4 |
5,33±0,67 |
7,25 |
5,0±0,57 |
16,6 |
|
E. coli норм. фермент. актив. |
7,65±0,3 |
6,9 |
7,59±0,26 |
5,9 |
7,45±0,18 |
4,16 |
В 40-суточном возрасте (рис.20) количество бифидобактерий у цыплят 1-й опытной группы увеличилось, по сравнению с контрольной, на 3,9 %, а у цыплят 2-й опытной группы находилось на том же уровне. В фекалиях цыплят 1-й и 2-й опытных групп содержание молочно-кислых бактерий было выше аналогов в контроле на 13,2 и 6,6 %, а количество E. coli - на 2,7 и 1,8 % (табл. 3).
Относительно 20-суточного возраста не отмечали дальнейшего значительного увеличения количества изучаемых бактерий в фекалиях цыплят опытных групп. У цыплят контрольной группы увеличилось количество бифидобактерий и уменьшилось содержание E. coli.
Закономерности, выявленные в процентном соотношении бактерий в 20-суточном возрасте, сохранялись и в 40-суточном (табл. 2,3).
Таким образом, у цыплят опытных групп под влиянием ветома 3 происходит максимальное заселение кишечника полезной микрофлорой в 20-суточном возрасте, у цыплят контрольной группы заселение кишечника бифидобактериями происходило и в 40-суточном возрасте. Следовательно, под влиянием ветома 3 ускоряется процесс заселения кишечника полезной микрофлорой и качественно изменяется микробный пейзаж в кишечнике. Содержание молочно-кислых и бифидобактерий увеличивалось, а количество E. coli уменьшалось по сравнению с аналогами в контроле. Положительные изменения микробиоценоза в кишечнике у цыплят бройлеров способствуют активизации процессов пищеварения, следовательно, и повышению продуктивности цыплят.

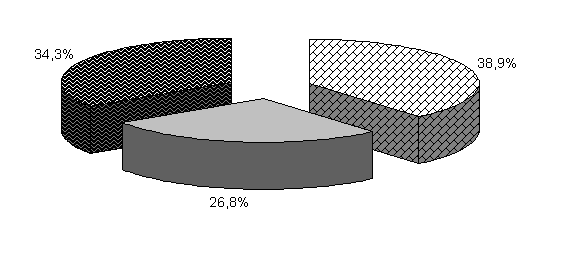
Рис.20. Количество микроорганизмов в фекалиях подопытных цыплят в 40-суточном возрасте.
При повторном проведении опытов для уточнения ранее полученных результатов ветом 3 вводили по 75 мг/кг массы 2 и 3 раза в сутки через 24 часа в течение месяца. До назначения препарата из фекалий цыплят выделяли бифидобактерии, молочно-кислые бактерии E. coli (табл. 4).
Таблица 4. Количество микроорганизмов в содержимом кишечника цыплят
в суточном возрасте, lg КОЕ/г
|
Показатели |
Группа |
|||||
|
1-я опытная |
2-я опытная |
Контрольная |
||||
|
М±m |
Cv |
М±m |
Cv |
М±m |
Cv |
|
|
Бифидобактерии |
4,67±0,21 |
6,0 |
4,33±0,33 |
9,8 |
4,50±0,22 |
6,4 |
|
Молочно-кислые бактерии |
2,83±0,40 |
20,3 |
3,17±0,66 |
19 |
3,0±0,45 |
21,9 |
|
E. coli норм. фермент. актив. |
6,45±00,4*** |
1,2 |
6,58±0,07*** |
2,1 |
6,58±0,07 |
2,1 |
Ранее отмеченные закономерности в процентном соотношении бактерий в фекалиях цыплят суточного возраста до применения препарата отмечали и в этой серии опытов (рис.21).
Под влиянием препарата у цыплят 1-й и 2-й опытных групп в 20-суточном возрасте происходит активное заселение кишечника бифидо- и молочно-кислыми бактериями. Количество бифидобактерий относительно исходных данных увеличивалось в 11,9 и 27,2 тыс. раз. По сравнению с контролем количество бифидобактерий в фекалиях цыплят 1-й и 2-й опытных групп было выше на 3,5 и 4,4 % соответственно. Количество молочно-кислых бактерий в фекалиях цыплят 1-й и 2-й опытных групп относительно исходных данных увеличивалось в 786 и 493,3 раза и было выше показателей цыплят из контрольной группы соответственно на 7,0 и 25,6 %. Количество E. coli у цыплят 1-й и 2-й опытных групп относительно исходных данных увеличивалось в 39 и 12,3 раза и было ниже показателей цыплят аналогов контрольной группы на 0,7 и 5,5 %. У цыплят контрольной группы также происходило увеличение микроорганизмов, но в меньшей степени: бифидобактерий - в 8,7 тыс. раз, молочно-кислых бактерий - в 470 раз, кишечной палочки - в 37 раз.
Изменялось и процентное соотношение изучаемых бактерий под влиянием ветома 3 относительно исходных данных (рис.22). В фекалиях цыплят 1-й и 2-й опытных групп, в 20-суточном возрасте E. coli содержалось 36,4 и 35,1 %, бифидобактерий – 39,5 и 38,1 %, молочно-кислых бактерий - 24,1 и 26,8 %. У птицы контрольной группы сохранялись ранее выявленные закономерности по процентному соотношению изучаемых бактерий: E. coli – 38,2 %, бифидобактерий - 39,8 %, молочно-кислых бактерий – 22,0 % (рис. 22).

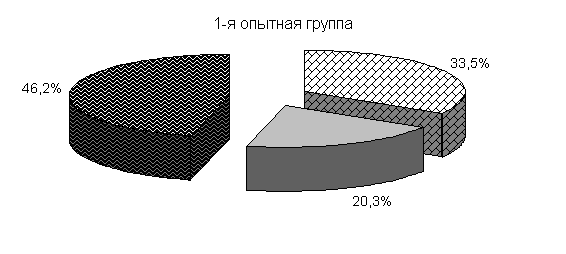
Рис.21. Количество микроорганизмов в фекалиях подопытных цыплят до применения препарата1-я опытная группа
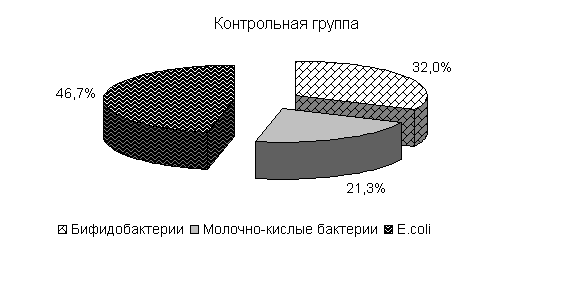
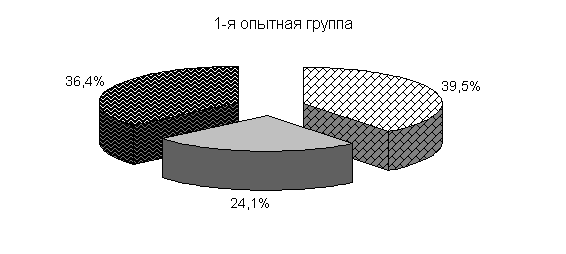
Рис.22. Количество микроорганизмов в фекалиях подопытных цыплят в 20-суточном возрасте
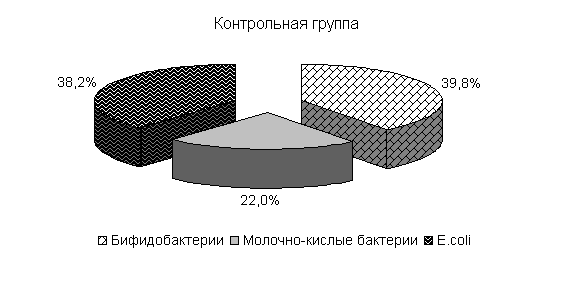
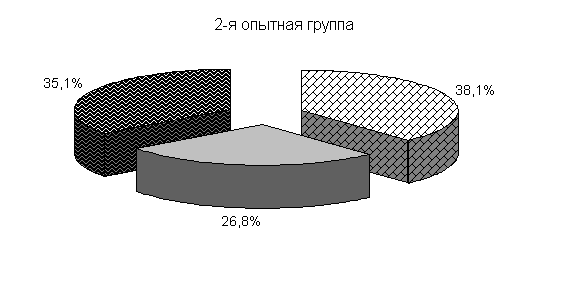
Таблица 5. Количество микроорганизмов в содержимом кишечника цыплят
в 20-суточном возрасте, lg КОЕ/г
|
Показатели |
Группа |
|||||
|
1-я опытная |
2-я опытная |
Контрольная |
||||
|
М±m |
Cv |
М±m |
Cv |
М±m |
Cv |
|
|
Бифидобактерии |
8,75±0,08# |
6,0 |
8,83±0,12* |
4,6 |
8,45±0,11 |
6,4 |
|
Молочно-кислые бактерии |
5,33±0,45 |
21,9 |
5,87±0,42 |
19,4 |
4,67±0,42 |
21,1 |
|
E. coli норм. фермент. актив. |
8,05±0,25 |
7,5 |
7,67±0,5 |
4,9 |
8,11±0,17 |
5,1 |
Таблица 6. Количество микроорганизмов в содержимом кишечника цыплят
в 40-суточном возрасте, lg КОЕ/г
|
Показатели |
Группа |
|||||
|
1-я опытная |
2-я опытная |
Контрольная |
||||
|
М±m |
Cv |
М±m |
Cv |
М±m |
Cv |
|
|
Бифидобактерии |
8,67±0,21 |
6,0 |
8,83±0,17 |
4,6 |
8,67±0,21 |
6,0 |
|
Молочно-кислые бактерии |
5,33±0,42 |
19,4 |
5,97±0,42 |
19,4 |
5,0±0,4 |
21,9 |
|
E. coli норм. фермент. актив. |
7,35±0,24 |
8,3 |
7,94±0,16* |
5,0 |
7,35±0,02 |
0,7 |
В 40-суточном возрасте количество бифидобактерий у цыплят 2-й опытной группы увеличивалось, по сравнению с контрольной группой, на 1,8 %, а показатели цыплят 1-й опытной группы были на уровне с контролем. Количество молочно-кислых бактерий в фекалиях цыплят 1-й и 2-й опытных групп превышало показатели цыплят из контрольной группы на 6,6 и 19,4 %. E. coli у цыплят 2-й опытной группы было выше на 8,0 %, а у цыплят 1-й опытной группы - на уровне с показателями цыплят контрольной группы (табл.6).
Относительно 20-суточного возраста не отмечали дальнейшего значительного увеличения количества изучаемых бактерий в фекалиях цыплят опытных групп. У цыплят контрольной группы количество бифидо- и молочно-кислых бактерий увеличивалось, а количество E. coli уменьшалось (рис. 23).
Изменение микробного пейзажа кишечника зависело от кратности применения препарата и преимущественно происходило у цыплят в 20-дневном возрасте. При назначении препарата 1 раз в сутки через 24 часа в течение месяца в дозе 75 мг/кг массы увеличивалось количество всех изучаемых микроорганизмов, бифидобактерий до (8,33±0,34) lg КОЕ/г; молочно-кислых бактерий до (5,33±0,67) lg КОЕ/г; E. coli до (7,64±0,57) lg КОЕ/г.
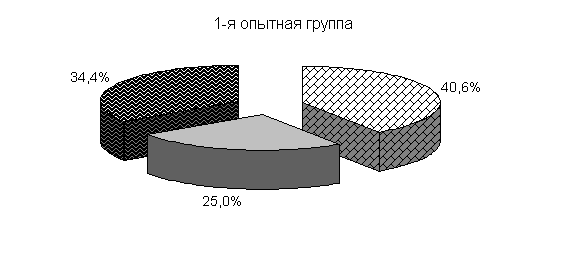
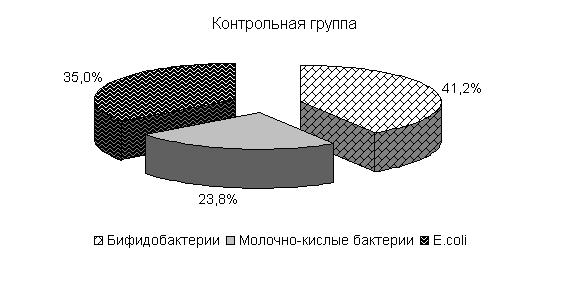
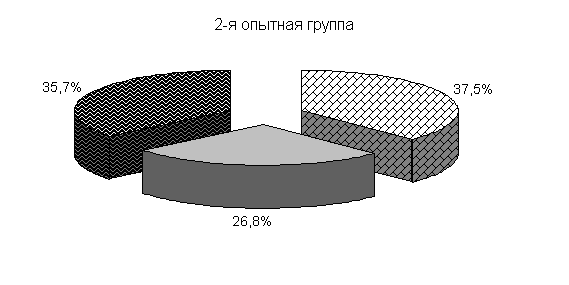
Рис.23. Количество микроорганизмов в фекалиях подопытных цыплят в 40-суточном возрасте
При введении препарата 2 раза в сутки через 24 часа в течение месяца в дозе 75 мг/кг массы максимальный уровень бифидобактерий составил (8,66±0,34) lg КОЕ/г; молочно-кислых бактерий (5,66±0,34) lg КОЕ/г; E. coli (7,58±0,38) lg КОЕ/г.
При назначении препарата 3 раза в сутки через 24 часа в течение месяца в дозе 75 мг/кг массы, максимальный уровень микроорганизмов у цыплят составил: бифидобактерий (8,83±0,12) lg КОЕ/г; молочно-кислых бактерий (5,87±0,42) lg КОЕ/г; E. coli (7,67±0,5) lg КОЕ/г. Темп колонизации кишечника в 40-суточном возрасте значительно снижался.
Более выраженные изменения микробиоценоза отмечали у цыплят, получавших ветом 3 в дозе 75 мг/кг массы 3 раза в сутки через 24 часа в течение месяца. Цыплята этой группы по показателям кишечного биоценоза превышали цыплят - аналогов из других опытных групп в 20, 40-дневном возрасте; при назначении препарата 1 раз в сутки через 24 часа в течение месяца по количеству бифодобактерий на 6,0 %, молочно-кислых бактерий на 10,1 и 12,0 %, E. coli - на 0,3 и 4,6 %. При назначении препарата 2 раза в сутки через 24 часа в течение месяца по количеству бифодобактерий на 1,9 %, молочно-кислых бактерий на 3,7 и 5,4 %, E. coli - на 1,2 и 3,8 %.
Таким образом, установлены определенные закономерности в изменении микробиоценоза кишечника под влиянием ветома 3. Более выраженные изменения бифидобактерий и молочно-кислых бактерий регистрировали в 20-суточном возрасте в период применения препарата. На 20-е сутки исследования количество E. coli у цыплят опытных групп было несколько ниже аналогов из контроля. На 40-е сутки исследования и с увеличением срока последействия препарата содержание в фекалиях цыплят бифидобактерий и молочно-кислых бактерий продолжало оставаться на высоком уровне. Количество E. coli у цыплят опытных групп находилось в пределах аналогов из контрольной группы.
САНАЦИЯ ПОМЕЩЕНИЙ С ИСПОЛЬЗОВАНИЕМ ПРОБИОТИКОВ
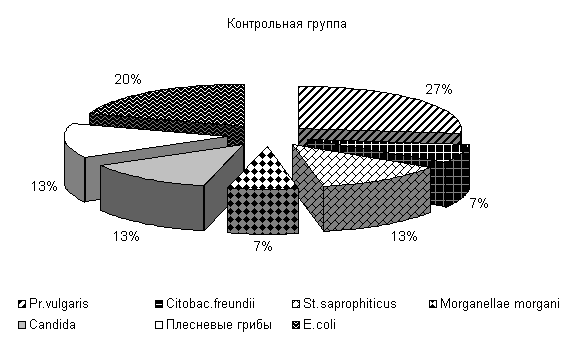
При исследовании смывов с объектов животноводческого помещения в учхозе «Тулинский» до проведения опыта были выделены следующие патогенные бактерии: Pr. vulgaris, Citobac. freundii, St. saprophiticus, Morganellae morgani, грибы рода Candida, плесневые грибы и условно-патогенные (E. coli) микроорганизмы.
В опытных клетках содержание Pr. vulgaris составляло 24 %, Citobac. freundii, St. saprophiticus, Morganellae morgani, грибы рода Candida по 13 %, плесневые грибы 6 % и E. coli 18 %, в контрольных клетках - соответственно 27, 7, 13, 7, 13, 13, 20 % от числа выделенных микроорганизмов (рис.24).
После обработки клеток препаратом «Ноздрин» установлены следующие изменения микробиоценоза. Содержание Pr. vulgaris составляет 11 %, E.coli – 21 %, Citobac. Freundii – 11 %, St. saprophiticus – 16 %, Morganellae morgani –5 %, грибы рода Candida – 16 %, плесневые грибы – 20 %. В контроле после обработки каустической содой количество Pr. vulgaris – 25 %, E. coli – 20 %, Citobac. freundii – 10 %, St. saprophiticus – 20 %, Morganellae morgani –5 %, грибы рода Candida и плесневые грибы по 10 % от общего количества выделенных штаммов( рис. 25).
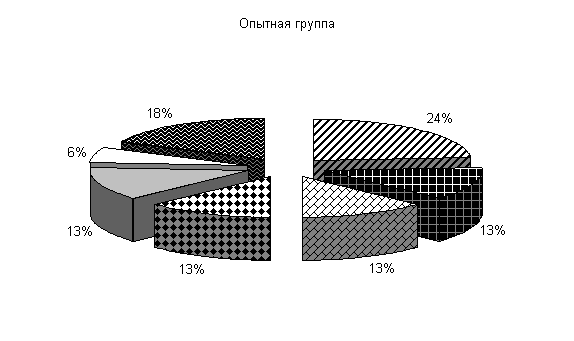
Рис.24. Микрофлора животноводческих помещений до опыта
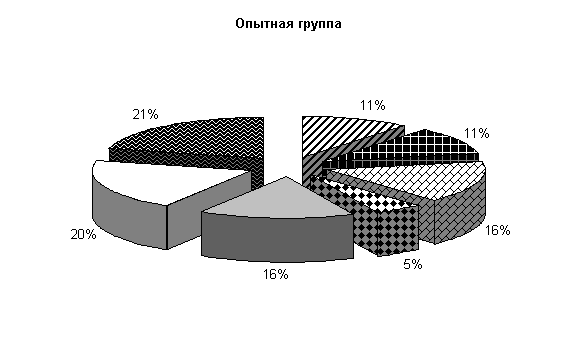
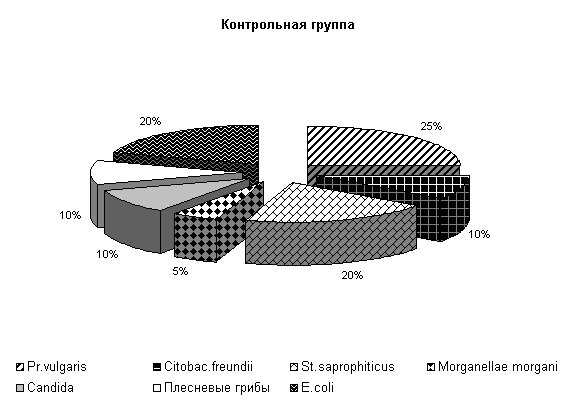
Рис.25. Микрофлора животноводческих помещений после опыта
После применения препарата «Ноздрин» по сравнению с исходными данными наблюдалось снижение уровня Pr. vulgaris на 13 %, общее количество E. coli возросло на 3 %, количество Morganellae morgani уменьшилось на 8 %, содержание грибов рода Candida увеличилось на 3 % и плесневых грибов на 14 %. В контроле количество Pr. vulgaris и Morganellae morgani уменьшилось на 2 %, E. coli осталось на прежнем уровне, грибов снизилось на 3 %.
В опытных клетках содержание Pr. vulgaris на 14 % меньше, E. coli и Citobac. freundii на 1 % больше, St. saprophiticus на 4 % меньше, грибов рода Candida и плесневых грибов больше на 6 и 10 % по сравнению с контролем. Количество Morganellae morgani в опыте и контроле одинаково.
Таким образом, под влиянием препарата «Ноздрин» резко уменьшается содержание в животноводческом помещении Pr. vulgaris. Незначительно понижается уровень Citobac. freundii, Morganellae morgani. Возрастает количество St. saprophiticus и E. coli, плесневых грибов и рода Candida.
Под влиянием каустической соды незначительно уменьшается количество Pr. vulgaris и Morganellae morgani, грибов. Резко повышается содержание St. saprophiticus, незначительно повышается Citobac. freundii. Уровень E. coli остается неизменным.
Аналогичные результаты получены при проведении опыта в ЭСХ СОРАН. До применения препаратов из смывов выделялись патогенные (St. aureus, Citobac. freundii, Pr. vulgaris) и условно-патогенные (E. coli) штаммы.
После обработки препаратом «Ноздрин» произошло снижение уровня St. aureus, E. coli, Pr. vulgaris. Citobac. freundii не выделялся. При использовании раствора едкого калия уменьшалось содержание St. aureus и E. coli. Pr. vulgaris и Citobac. freundii не выделялись.
Сравнивая результаты опытных и контрольных смывов, можно сказать, что происходит полное подавление роста Citobac. freundii. Сходным действием препараты обладают в отношении E. coli, вызывая уменьшение ее количества. Едкий калий более эффективен в отношении St. aureus, Pr. vulgaris, чем препарат «Ноздрин».
При применении препарата «Ноздрин» прослеживается тенденция к подавлению роста и снижению уровня некоторых патогенных микроорганизмов в животноводческом помещении. Каустическая сода и едкий калий являются более эффективными препаратами по отношению к патогенным и условно-патогенным микроорганизмам.
ЗАКЛЮЧЕНИЕ
В условиях Западной Сибири условно-патогенная и патогенная микрофлора являются основными причинами в возникновении желудочно-кишечных заболеваний и эндометритов. Проведенные исследования свидетельствуют о том, что изучаемые нами новые препараты оказывают влияние на микробиологический ценоз желудочно-кишечного тракта, репродуктивных органов и животноводческого помещения. Нами установлено, что при лечении заболеваний желудочно-кишечного тракта и репродуктивных органов с использованием пробиотиков происходят количественные и качественные изменения микробиоценоза в желудочно-кишечном тракте, фекалиях, матке, цервикальной слизи и среде обитания.
При применении ветома 1.1 и антибиотиков для лечения выявлены выраженные закономерности по изменению микробной экосистемы в желудочно-кишечном тракте у телят, а, следовательно, и в среде их обитания.
В начальный период применения антибиотиков происходит полное подавление нормальной микрофлоры с последующим постепенным восстановлением до исходного уровня и уменьшение общего количества E. coli с высоким процентным содержанием ее патогенных штаммов. Содержание Ent. aerogenos и Prot. vulgaris незначительно снижается только в 1-й период терапии с последующим сохранением высокого их уровня.
При назначении ветома 1.1 отмечается тенденция к увеличению нормальной микрофлоры на протяжении всего опыта. И в конце эксперимента ее количество выше, чем в контроле. В начале применения препарата не отмечалось выраженного действия на Ent. aerogenos и Prot. vulgaris. Общее количество E. coli незначительно увеличивалось при уменьшении содержания ее патогенных штаммов. В дальнейшем (после клинического выздоровления животных) отмечается снижение патогенных штаммов E. coli и Ent. aerogenos. Prot. vulgaris в фекалиях не обнаруживается.
Таким образом, антибиотик оказывает отрицательное влияние на формирование микробной экосистемы желудочно-кишечного тракта и способствует возникновению дисбактериозов. Изменение микробной экосистемы желудочно-кишечного тракта под влиянием ветома 1.1 имеет благоприятный характер и не только обеспечивает нормальное течение патологического процесса и более высокий терапевтический эффект, но и снижает бактериальную обсемененность окружающей среды этими штаммами. Следовательно, ветом 1.1, уменьшая количество патогенных штаммов бактерий и улучшая микробиоценозы среды обитания животных, может способствовать снижению заболеваемости у телят в ранний постнатальный период жизни.
После лечения гастроэнтеритов у поросят с применением ветома 3 также повышалось общее количество E. coli с резким уменьшением процентного содержания ее патогенных штаммов. Препарат оказывал выраженное антагонистическое влияние на ряд патогенных микробов и уменьшал их процентное содержание.
Следовательно, ветом 1.1 и ветом 3 способствуют увеличению бифидо- и молочно-кислых бактерий представителей нормальной микрофлоры кишечника у животных и обеспечивают колонизационную резистентность, которая предотвращает заселение организма условно-патогенными и патогенными микробами. Постоянное присутствие в кишечнике адгезированных на его стенке резидентных микроорганизмов предотвращает размножение патогенов, их внедрение в энтероциты и прохождение через кишечную стенку. Кишечные бактерии защищают хозяина от патогенов, а также формируют переднюю линию слизистой защиты. Благодаря успешной конкуренции за необходимые питательные вещества или за эпителиальные сайты прикрепления, они предотвращают кишечную колонизацию патогенными микроорганизмами.
Уменьшение концентрации патогенной микрофлоры в кале животных при лечении пробиотиками способствует снижению бактериальной обсемененности окружающей среды болезнетворными микроорганизмами, что позитивно сказывается на динамике заболеваемости органов пищеварения у животных в ранний постнатальный период жизни.
Увеличение полезной микрофлоры в желудочно-кишечном тракте молодняка, фекалиях свидетельствует о позитивном влиянии ветома 1.1 и ветома 3 на экосистему органов пищеварения и улучшает микробиологическое состояние среды обитания животных и человека.
Аналогичное влияние на экосистему в животноводческих помещениях оказывал испытуемый нами препарат «Ноздрин». Установлено, что препарат обладает антимикробным действием в отношении условно-патогенной и патогенной микрофлоры среды обитания животных. Наиболее выраженное действие препарата отмечали в отношении Pr. vulgaris и Citrobac. freundii. В меньшей степени препарат оказывал влияние на рост St. aureus, E. coli и не действовал на грибы плесневые и рода Candida. Учитывая характер влияния применяемого препарата на бактериальную микрофлору животноводческого помещения, можно сделать вывод, что препарат можно использовать в качестве антимикробного средства для санации животноводческих помещений.
Состав микрофлоры репродуктивных органов при гнойно-катаральном эндометрите зависит от времени года. В летний период из цервикальной слизи выделяют: Ps. aeruginosa – 58,4 %, E. coli и споровые палочки по 8,3 %; в зимний стойловый период - E. coli и S. aureus по 29 %, Str. pneumoniae – 19 %, Pr. vulgaris – 14 %, Mic. pyogenus – 7 % и Bac. pyocyаneum – 2 %. Летом микробиоценоз представлен преимущественно монокультурами, а зимой - в виде ассоциаций из 2 культур и более.
Нами установлено позитивное влияние испытуемого препарата ветомгин при внутриматочном введении на состав условно-патогенной микрофлоры репродуктивных органов у коров при лечении эндометритов. Предлагаемые схемы терапии обеспечивают достоверное подавление роста условно-патогенных микроорганизмов в матке на 10-е, 20-е сутки. Наиболее выраженное действие препаратов выявлено в отношении Enterococcus fecalis и Enterococcus faecium, рост которых подавлялся уже к 5-м суткам лечения. Применяемые средства предохраняли коров опытных групп от отрицательного воздействия Proteus vulgaris, не допуская его развития в матке в период болезни. В то же время при традиционной схеме лечения аналогов из контроля в маточной слизи появлялся Proteus vulgaris, заболевание переходило в затяжную хроническую форму, и выздоровление не наступало даже на 30‑е сутки терапии.
Таким образом, рекомендуемые нами средства для лечения желудочно-кишечных заболеваний молодняка, гинекологических заболеваний коров и санации среды их обитания оказывают позитивное влияние на микробиологическую экосистему органов пищеварения, репродуктивных органов и животноводческих помещений, подавляя рост как условно-патогенных, так и патогенных штаммов микроорганизмов. Оптимальные результаты можно получить при одновременном применении препаратов животным с профилактической и лечебной целью и обработке животноводческих помещений. Для оптимизации экологической среды обитания животных, профилактики заболеваний, повышения продуктивности и улучшения качества продукции необходимо провести комплексное изучение пробиотических препаратов и разработать методики их применения.
СОДЕРЖАНИЕ
Введение …………………………………………………………………… 3
Пробиотики как экологически безопасные средства
профилактики и терапии болезней животных …………………………… 4
Влияние ветома 1.1 и антибиотиков на состав микрофлоры
желудочно-кишечного тракта у телят при диспепсии
и гастроэнтерите органов пищеварения у телят ………………………… 8
Влияние ветома 3 и антибиотиков на состав микрофлоры
желудочно-кишечного тракта у поросят при гастроэнтерите ………… 15
Влияние ветомгина на состав микрофлоры матки у коров
при остром гнойно-катаральном эндометрите …………………………. 19
Влияние ветомгина на бактериальную обсемененность
и качество молока ………………………………………………………… 28
Влияние ветома 3 на состав микрофлоры органов
пищеварения у цыплят …………………………………………………… 34
Санация помещений с использованием пробиотиков ………………… 44
Заключение ……………………………………………………………….. 48
Авторы:
Ноздрин Григорий Антонович
Иванова Анжела Борисовна
Ноздрин Александр Григорьевич
Оптимизация микробиоценозов среды обитания
животных путем направленного изменения
микробных экосистем с использованием пробиотиков
Рекомендации
Редактор Н.К. Куприна
Компьютерная верстка Т.В. Плотникова
Подписано в печать 30 октября 2003 г.
Формат 60´84 1/16 Объем 3,3 уч.-изд. л.
Тираж 100 экз. Изд. № 175. Заказ №
Издательский центр «Агро»
630039, Новосибирск,
ул. Добролюбова, 160







