Процедура государственной регистрации БАД
на территории Российской Федерации
Рассмотрим порядок действий юридического лица (изготовителя или продавца), принявшего решение производить и/или поставлять на рынок Биологически активную добавку (далее – БАД).
Стоит сразу отметить, что ни организация, уполномоченная осуществлять розничную продажу БАД (согласно п. 7.4. СанПиН 2.3.2.1290-03: розничная торговля БАД осуществляется через аптечные учреждения (аптеки, аптечные магазины, аптечные киоски и другие), ни специализированные магазины по продаже диетических продуктов, продовольственные магазины (специальные отделы, секции, киоски), не возьмет БАД на реализацию без соответствующих разрешающих документов, а именно:
- свидетельства о государственной регистрации на территории Российской Федерации;
- декларации соответствия;
- качественного удостоверения на БАД от Изготовителя.
Первый документ, с которым сталкивается Изготовитель – это СанПиН 2.3.2.1290 – 03 «Гигиенические требования производства и оборота биологически активных добавок к пище (БАД)». Он определяет ряд основных моментов, закладывающих основу дальнейшей судьбы БАД, а именно:
- требования к технической документации по производству БАД (раздел III СанПиН 2.3.2.1290 – 03). Здесь стоит остановиться и сделать акцент на том, что нельзя взять сахарную пудру и лимонную кислоту, смешать и зарегистрировать как БАД. Подобный продукт будет остановлен еще на стадии экспертизы технической документации: технических условий (ТУ) и технологической инструкции (ТИ);
- требования к упаковке БАД и информации, нанесенной на этикетки (раздел IV СанПиН 2.3.2.1290 – 03). При подаче БАД на экспертизу потребительская упаковка должна быть снабжена этикетой, на которую нанесена регламентированная законодательством информация, в дальнейшем, если БАД пройдет успешную регистрацию, Изготовитель будет обязан наносить на каждую этикетку номер свидетельства о государственной регистрации и дату его выдачи;
- санитарно – эпидемиологические требования к производству БАД. Этот пункт имеет отношение прежде всего к Изготовителю. Без получения санитарно – эпидемиологического заключения, в котором территориальный орган Роспотребнадзора (приложение № 2 к Административному регламенту) даст положительную оценку условиям (проще говоря, назовет их «соответствующими»), производство и регистрация БАД невозможны.
Итак, Изготовитель разработал ТУ, ТИ, разработал и изготовил макет этикетки, получил санитарно – эпидемиологическое заключение на производство.
Теперь он может приступить к следующей стадии регистрации БАД: изготовить партию БАД, упаковать ее в потребительскую упаковку, соответствующую СанПиН 2.3.2.1290 – 03, наклеить этикетки в соответствии с этим же нормативным документом, и начать процедуру регистрации.
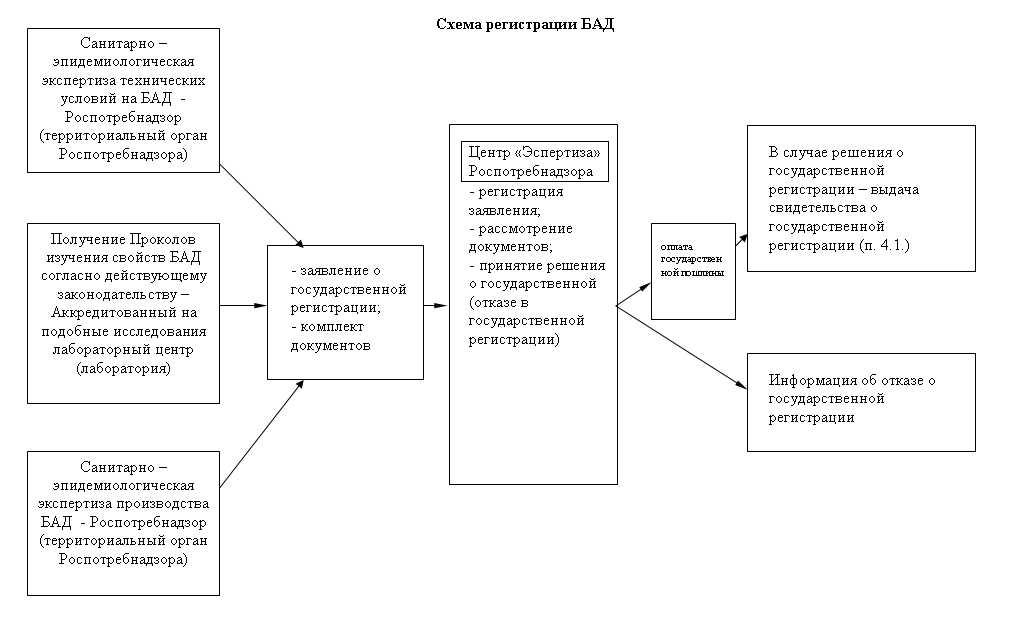
Согласно Административному регламенту Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека исполнения государственной функции по государственной регистрации впервые внедряемых в производство и ранее не использовавшихся химических, биологических веществ и изготовляемых на их основе препаратов, потенциально опасных для человека (кроме лекарственных средств); отдельных видов продукции, в том числе пищевых продуктов, впервые ввозимых на территорию РФ, утвержденному Приказом Министерства здравоохранения и социального развития № 657 от 19 октября 2007 года, Изготовитель (и/или продавец) предоставляет в
Регистрирующий орган (центр «Экспертиза» Роспотребнадзора www.crc.ru ) следующие документы (Приложение № 5 к Административному регламенту):
- заявление, оформленное в соответствии с Приложением 4 к Административному регламенту;- ТУ, ТИ, рецептуру на БАД, по которым предполагается осуществлять промышленное изготовление продукции, заверенные в установленном законодательством Российской Федерации порядке;
- если ТУ и ТИ Изготовителя уже прошли ранее экспертизы, необходимо предоставить санитарно – эпидемиологическое заключение о подтверждении, заверенное в установленном законодательством Российской Федерации порядке;
- санитарно – эпидемиологическое заключение о соответствии условий производства требованиям государственных санитарно-эпидемиологических правил и нормативов, заверенное в установленном законодательством Российской Федерации порядке;
- инструкцию по применению (листок-вкладыш, аннотация) (в случае, если вся необходимая информация не может быть размещена на этикетке), заверенную подписью уполномоченного лица и печатью Изготовителя;
- потребительскую (или тарную) этикетку или ее проект, заверенный подписью уполномоченного лица и печатью Изготовителя;
- протоколы испытаний аккредитованных испытательных лабораторий (центров), заключения аккредитованных организаций (органолептические, физико-химические, микробиологические, радиологические исследования (испытания), исследования допустимого содержания химических, радиологических, биологических объектов, запрещенных компонентов и их соединений, микроорганизмов и других биологических агентов, представляющих опасность для здоровья человека в соответствии с государственными санитарно-эпидемиологическими правилами и нормативами);
- акт отбора образцов (проб) установленной формы;- при наличии товарного знака – копия свидетельства на товарный знак, заверенная в установленном порядке
- в случае, если Изготовитель и Заявитель являются разными юридическими лицами (либо Изготовителя представляет в регистрирующем органе физическое лицо), при подаче заявления и комплекта документов необходима доверенность Изготовителя о том, что он доверяет заявителю представлять свои интересы на территории Российской Федерации по осуществлению государственной регистрации продукции изготовителя, а также доверенность на право получения свидетельства о государственной регистрации БАД.
Возвращаясь немного назад, отметим, что на руках у нас имеются все документы из списка, кроме одного: протокола испытаний аккредитованного испытательного центра (лаборатории).
Экспертизы (санитарно-эпидемиологические экспертизы, а также исследования, испытания, токсикологические, гигиенические и иные виды оценок), необходимые для государственной регистрации, осуществляются федеральными государственными учреждениями – центрами гигиены и эпидемиологии (перечень учреждений размещается на официальном сайте в сети Интернет Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека: www.rospotrebnadzor.ru ), другими организациями, аккредитованными в установленном порядке (перечень организаций размещается на официальном сайте в сети Интернет Федерального агентства по техническому регулированию и метрологии: www.gost.ru ).
Однако, согласно приложению к Приказу от 12.11.2007 г. № 319 «О перечне организаций, осуществляющих санитарно-эпидемиологические экспертизы» Роспотребнадзором утвержден Примерный перечень организаций, которые могут осуществлять санитарно-эпидемиологические экспертизы, гигиенические, токсикологические и иные виды оценок для целей выдачи санитарно-эпидемиологических заключений :
-
ФГУЗ «Федеральный центр гигиены и эпидемиологии» Роспотребнадзора.
-
ФГУЗ «Центр гигиены и эпидемиологии в г. Москве» Роспотребнадзора.
-
ГУ НИИ медицины труда РАМН (по согласованию).
-
ГУ НИИ экологии человека и гигиены окружающей среды им. А.Н. Сысина РАМН (по согласованию).
-
Федеральный научный центр гигиены им. Ф.Ф.Эрисмана Роспотребнадзора.
-
ГУ НИИ питания РАМН (по согласованию).
-
Научно-исследовательский институт гигиены и охраны здоровья детей и подростков РАМН (по согласованию).
-
НИИ физико-химической медицины Росздрава (по согласованию).
-
Российская медицинская академия последипломного образования Росздрава (по согласованию).
-
ФГУН «Санкт-Петербургский научно-исследовательский институт радиационной гигиены имени профессора П.В. Рамзаева» Роспотребнадзора.
Разумеется, это не отменяет право Изготовителя обратиться для получения протоколов испытаний в любой другой аккредитованный на такие исследования центр или лабораторию, однако указанные в перечне лабораторные центры легитимны и выданные ими протоколы безусловно будут приняты органом государственной регистрации БАД.
Таким образом, Изготовитель собрал все необходимые документы и подал их в регистрирующий орган. Регистрирующий орган регистрирует заявление, проводит экспертизу документов и в случае отсутствия нареканий, выносит решение о государственной регистрации БАД. Изготовитель оплачивает госпошлину за выдачу свидетельства, запись о зарегистрированной БАД вносится в Федеральный реестр БАД http://fp.crc.ru/gosregfr /, свидетельство о государственной регистрации выдается заявителю.
Процедура регистрации завершена.
Далее Изготовитель должен оформить на зарегистрированный БАД согласно Постановлению Правительства РФ № 982 от 01.12. 2009 «Об утверждении единого перечня продукции, подлежащей обязательной сертификации и единого перечня продукции, подтверждение соответствия которой осуществляется в форме принятия декларации и соответствии» декларацию соответствия и БАД, сопровождаемый свидетельством о государственной регистрации, декларацией соответствия и качественным удостоверением Изготовителя, имеет законное основание поступить на прилавки уполномоченных организация для реализации населению.
Документы:
2. СанПиН 2.3.2.1078-01.doc (документ MS Word 3 448 КБ).
3. СанПиН 2.3.2.1290-03.doc (документ MS Word 249 КБ).